5 березня, 2025
Лікування цукрового діабету 2 типу в пацієнтів старшого віку
Світова популяція неухильно старіє. Збільшення тривалості життя є в т. ч. наслідком прогресу медичної науки: вдосконалення методів лікування та покращення профілактики основних хвороб. Отже, з одного боку, фармакотерапія дозволила відтермінувати час настання небезпечних для життя ускладнень хронічних хвороб, а з іншого – значно збільшила величезний контингент пацієнтів, які потребують складних режимів лікування. В осіб літнього віку (ОЛВ) часто спостерігається неналежне призначення ліків у формі або надмірної, або недостатньої фармакотерапії. Нерідко в основі цього неналежного призначення лежить своєрідний ейджизм – ухвалення рішень на основі винятково хронологічного віку.
Старіння є неуникним процесом, який найпростіше визначати на основі віку; зазвичай до ОЛВ належать люди віком ≥65 років, хоча деякі автори пропонують змістити цей віковий поріг до ≥70, а то й до ≥75 років. Однак процес старіння не є однорідним у всіх людей через відмінності в генетиці, спосіб життя та загальний стан здоров’я; отже, не завжди літній вік є сурогатом високого ступеня коморбідностей та старечої астенії. Це обумовлює потребу в персоналізованому пацієнт-центрованому підході до лікування із врахуванням як безпосередньо віку, так і функціональних можливостей та профілю супутніх захворювань кожної конкретної людини (Singh S., Bajorek B., 2014). За даними Всесвітньої організації охорони здоров’я, станом на 2021 рік середньостатистична очікувана тривалість життя в Україні становила 70,9 року, тобто була меншою за середньосвітовий (71,4 року) та середньоєвропейський (76,3 року) показники, причому ця статистика проводилася ще до повномасштабного вторгнення. Імовірно, саме тому в Україні до ОЛВ мають належати пацієнти віком <65 років.
Паралельно до збільшення тривалості життя та поширеності надмірної маси тіла й ожиріння стабільно зростає і поширеність цукрового діабету (ЦД) 2 типу. В ОЛВ (>65 років) із ЦД спостерігається приблизно такий самий ризик мікросудинних ускладнень, як і в молодших пацієнтів, однак ризик макроваскулярних ускладнень є достовірно вищим. Окрім того, в ОЛВ із ЦД спостерігається високий ризик поліпрагмазії, функціональних порушень та інших геріатричних синдромів (когнітивних розладів, нетримання сечі, депресії, падінь і хронічного болю). Наведені в цьому матеріалі рекомендації щодо лікування ОЛВ із ЦД 2 типу ґрунтуються на клінічних дослідженнях і відповідають настановам Американського товариства геріатрії, Американської діабетологічної асоціації, Канадської діабетологічної асоціації, Ендокринологічного товариства, Міжнародної федерації діабету, Європейської робочої групи з питань діабету та Американської колегії лікарів (Munshi M., 2024).
Особливості ведення ЦД 2 типу в ОЛВ
Глікемічні цілі для ОЛВ мають бути індивідуалізованими та ґрунтуватися на загальному стані здоров’я, очікуваній тривалості життя, ризику гіпоглікемії, а також рівні прихильності до лікування. Так, для відносно здорових ОЛВ із ЦД, які отримують фармакотерапію, цільовий показник глікованого гемоглобіну (HbA1с) становить <7,5%, а рівень глікемії натще / препрандіальної глікемії знаходиться в межах 7,8-8,3 ммоль/л. Для ОЛВ зі значущими коморбідними станами, старечою астенією та/або очікуваною тривалістю життя <10 років цільовий рівень HbA1с має складати ≤8%, глікемії натще / препрандіальної глікемії – 8,9-9,4 ммоль/л. Для ОЛВ із незадовільним станом здоров’я (тяжкими коморбідними станами та/або когнітивними і функціональними порушеннями) цільовий рівень HbA1с може бути ще вищим, наприклад <8,5%, а основними цілями мають бути збереження якості життя й уникнення гіпоглікемії та тяжкої гіперглікемії (>19,4 ммоль/л).
Важливий аспект лікування ОЛВ із ЦД – уникнення гіпоглікемії. У цього контингенту частіше спостерігаються нейроглікопенічні прояви (запаморочення, слабкість, сплутаність свідомості), а не адренергічні (тремор, посилене потовиділення), що відтерміновує розпізнання гіпоглікемії.
Стартове лікування ЦД 2 типу в ОЛВ відповідає настановам для молодших пацієнтів і передбачає модифікацію харчування, підвищення рівня фізичної активності, оптимізацію метаболічного контролю, зниження маси тіла (за потреби). Фізичні навантаження допомагають зберегти фізичні функції, знизити кардіоваскулярний ризик і підвищити чутливість до інсуліну, а в ОЛВ також зменшують артритичні болі, знижують ризик падінь та імовірність депресії, покращують якість життя, підвищують виживаність.
Що стосується їжі, то зміни відчуття смаку, коморбідні захворювання, часткова/повна відсутність зубів, харчові обмеження, погіршена функція травної системи, знижена пам’ять, труднощі із закупівлею продуктів і приготуванням їжі ускладнюють налагодження правильного харчування, тому складного дієтологічного лікування в ОЛВ варто уникати.
Стартова фармакотерапія
Дані щодо фармакотерапії в ОЛВ обмежені, хоча більшість клінічних досліджень включають пацієнтів із ЦД 2 типу >65 років. Загалом підхід до вибору стартового, альтернативного та комбінованого лікування в ОЛВ і молодших осіб є аналогічним. У ОЛВ доцільно надавати перевагу препаратам із низьким ризиком гіпоглікемії. Для більшості ОЛВ стартовою терапією є метформін (за відсутності протипоказань). У більшості хворих із надлишковою масою тіла або ожирінням метформін призначають у поєднанні з модифікацією способу життя, спрямованою на зниження маси тіла.
Метформін – привабливий препарат для застосування в ОЛВ через низький ризик гіпоглікемії, однак у пацієнтів із HbA1с, який незначно перевищує цільовий рівень, або в осіб із численними коморбідними станами доцільно спробувати нормалізувати глікемію за допомогою 3-6-місячного пробного періоду модифікації способу життя. Зазвичай лікування метформіном розпочинають з 500 мг/добу з поступовим підвищенням дози протягом декількох тижнів. З огляду на те що в ОЛВ спостерігається підвищений ризик патологічних станів, які погіршують функцію нирок або зумовлюють лактоацидоз, метформін слід застосовувати з обережністю. Пацієнтів також необхідно попереджати про негайне припинення вживання метформіну в разі будь-якого тяжкого захворювання або за потреби візуалізаційного дослідження із застосуванням йодного контрасту. Функцію нирок слід моніторувати 1 раз на 3-6 міс.
В осіб із ЦД 2 типу зі стартовим HbA1с >9%, рівнем глюкози натще >13,9 ммоль/л, постійним рівнем глюкози при випадковому визначенні >16,7 ммоль/л або кетонурією стартовим лікуванням може бути інсулінотерапія. Через ризик гіпоглікемії інсулін часто застосовують лише протягом нетривалого періоду для усунення глюкозотоксичності: минущого пригнічення функції β-клітин і підвищеної інсулінорезистентності, зумовлених тривалим впливом високих концентрацій глюкози. Після покращення секреції інсуліну та чутливості до нього дозу інсуліну можна знизити або замінити інсулін на метформін чи інший засіб із нижчим ризиком гіпоглікемії.
Загалом, оскільки безпосередніх порівнянь препаратів в умовах клінічних досліджень досить мало, слід застосовувати індивідуальний підхід до лікування на основі стану пацієнта. Правило «розпочинайте з низьких доз і повільно їх підвищуйте» завжди є хорошим принципом, коли йдеться про запровадження нових фармакологічних препаратів у ОЛВ. У цього контингенту пацієнтів слід уникати поліпрагмазії та занадто складних режимів лікування, а також відстежувати типові геріатричні синдроми (насамперед когнітивні розлади та деменцію). Незважаючи на обмежені можливості лікування, виявлення деменції дозволяє оцінити здатність пацієнта до самоконтролю ЦД. Скринінг депресії та когнітивних функцій необхідно проводити за неприхильності до лікування, частих епізодів гіпоглікемії або надмірних коливань рівня глюкози, погіршення глікемії без відомої причини.
У випадку недостатньої відповіді на лікування необхідно перевірити прихильність до фармакотерапії, з’ясувати побічні ефекти інших ліків і дотримання плану харчування. Додатковими перешкодами на шляху до досягнення нормоглікемії в ОЛВ є когнітивні розлади, депресія та соціально-фінансові проблеми. За стійкої гіперглікемії понад верхню межу індивідуальних цільових показників, яка зберігається, незважаючи на модифікацію способу життя та вживання метформіну, слід додати другий препарат.
Додавання другого препарату
У разі тяжкої (HbA1с >9%) або стійкої симптоматичної гіперглікемії перевагу надають інсуліну. Додавання базального інсуліну 1 р/добу до неінсулінового препарату є нескладним терапевтичним режимом із відносно низьким ризиком гіпоглікемії порівняно з множинними ін’єкціями інсуліну. Зазвичай лікування розпочинають з інсуліну тривалої дії (10 Од або 0,2 Од на 1 кг маси тіла) зранку. Дозу інсуліну коригують раз на тиждень з обережною титрацією. У випадку швидкості клубочкової фільтрації <50 мл/хв/1,73 м2 дозу необхідно зменшити.
Якщо в пацієнта встановлено діагноз серцево-судинного чи ниркового захворювання, доцільно другим препаратом додати інгібітор натрійзалежного котранспортера глюкози 2 типу (ІНЗКТГ-2) або агоніст рецепторів глюкагоноподібного пептиду‑1 (арГПП‑1). Застосування ІНЗКТГ-2 слід уникати в пацієнтів із частими бактерійними або дріжджовими інфекціями сечостатевої системи, низькою щільністю кісткової тканини та високим ризиком падінь і переломів, виразками стопи й факторами ризику діабетичного кетоацидозу (недостатність підшлункової залози, зловживання алкоголем або наркотичними речовинами).
Окрім ІНЗКТГ-2 та арГПП‑1, в ОЛВ із підвищеним ризиком гіпоглікемії застосовуються інгібітори дипептидилпептидази‑4 (ІДПП‑4), проте ці препарати здатні усунути лише незначну гіперглікемію, оскільки вони можуть знижувати HbA1с лише на 0,6%.
Якщо важливим для пацієнта є фінансове питання, доцільним буде додавання препарату сульфонілсечовини (ПСС). Сучасні ПСС дозволяють збалансувати глюкозознижувальну ефективність, високу доступність, низькі вартість та ризик гіпоглікемії, збільшення маси тіла. Типовою стартовою дозою для гліпізиду є 2,5 мг за 30 хв до сніданку, гліклазиду негайного вивільнення – 40 мг 1 р/добу, глімепіриду – 1 мг під час сніданку чи першого основного прийому їжі.
Сучасні ПСС – раціональний вибір
Слід зауважити, що в клінічних випробуваннях протидіабетичних препаратів, як-от ІДПП‑4, арГПП‑1, ІНЗКТГ-2, через побоювання щодо підвищеного ризику побічних ефектів, поліморбідності, складності контролю глікемії тощо часто застосовували суворі критерії включення, що обмежували участь пацієнтів старшого віку. Натомість у дослідженнях препаратів, як-от метформін і ПСС, зазвичай не було таких жорстких вікових обмежень, оскільки ці препарати розроблялися в часи, коли регуляторні вимоги були менш суворими, а популяції досліджуваних – ширшими.
Загалом сучасні ПСС можуть бути раціональними другими препаратами в разі недостатнього контролю глікемії за допомогою монотерапії метформіном. Глімепірид – найновіший і найсучасніший представник цього класу, єдиний ПСС ІІІ покоління. Глімепірид відрізняють покращений профіль безпеки завдяки високій селективності до рецепторів β-клітин підшлункової залози, подвійний механізм дії, справжня (обумовлена властивостями молекули, а не лікарською формою MR) 24-годинна тривалість дії, низький ризик гіпоглікемій, відсутність збільшення маси тіла та низка корисних позапанкреатичних ефектів (Basit A. et al., 2012). Ці переваги є особливо важливими для пацієнтів із ЦД 2 типу старшого віку.
Антигіперглікемічна ефективність глімепіриду відповідає показникам нових класів препаратів, наприклад дапагліфлозину. Через 52 тиж подвійної терапії комбінація метформіну та дапагліфлозину дозволила знизити HbA1с на 0,82%, а метформіну і глімепіриду – на 0,99% (Muller-Wieland D. et al., 2018). У дослідженні LEAD‑2 через 26 тиж уміст HbA1с знизився на ≈1,0% у групах 1,2 мг і 1,8 мг ліраглутиду 1 р/добу й глімепіриду (4 мг/добу). Для 0,6 мг ліраглутиду зниження було менш вираженим і становило 0,7%, а в групі плацебо HbA1с зріс на 0,1% (Nauck M. et al., 2009). Ліраглутид також не покращував індексу поздовжнього функціонального резерву лівого шлуночка порівняно із глімепіридом та підвищував частоту серцевих скорочень у спокої. Покращення показників HbA1с в обох групах було однаковим (Nystrom T. et al., 2017).
Вагомою перевагою глімепіриду є відмінні показники кардіоваскулярної безпеки. Так, відповідно до рекомендацій Європейського товариства кардіологів щодо лікування ЦД, предіабету та серцево-судинних захворювань, розроблених у співпраці з Європейською асоціацією з вивчення діабету (2019), додавання до лікування ЦД ПСС ефективно знижує кардіоваскулярний ризик порівняно лише з модифікацією способу життя, причому новітні ПСС, як-от глімепірид, асоціюються з порівняно меншою кількістю побічних ефектів, випадків гіпоглікемії чи кардіоваскулярної токсичності (Cosentino F. et al., 2020). За даними дослідження TOSCA-IT, застосування глімепіриду забезпечувало аналогічний піоглітазону ризик серцево-судинних подій (Vaccaro O. et al., 2017). Під час проведення проспективного когортного дослідження W. He та співавт. (2023) виявлено результати, що вражають: застосування глімепіриду пацієнтами із ЦД і хронічною серцевою недостатністю (СН) асоціювалося з достовірно нижчими показниками смертності від усіх причин (відношення ризиків (ВР) 0,47; 95% довірчий інтервал (ДІ) 0,35-0,63; р<0,001), кардіоваскулярної смертності (ВР 0,34; 95% ДІ 0,24-0,48; р<0,001), кількості госпіталізацій та звернень по невідкладну допомогу щодо СН (ВР 0,42; 95% ДІ 0,36-0,50; р<0,001), а також госпіталізацій щодо гострого інфаркту міокарда й інсульту (ВР 0,53; 95% ДІ 0,38-0,73; р<0,001) порівняно з відсутністю його застосування (рис.).
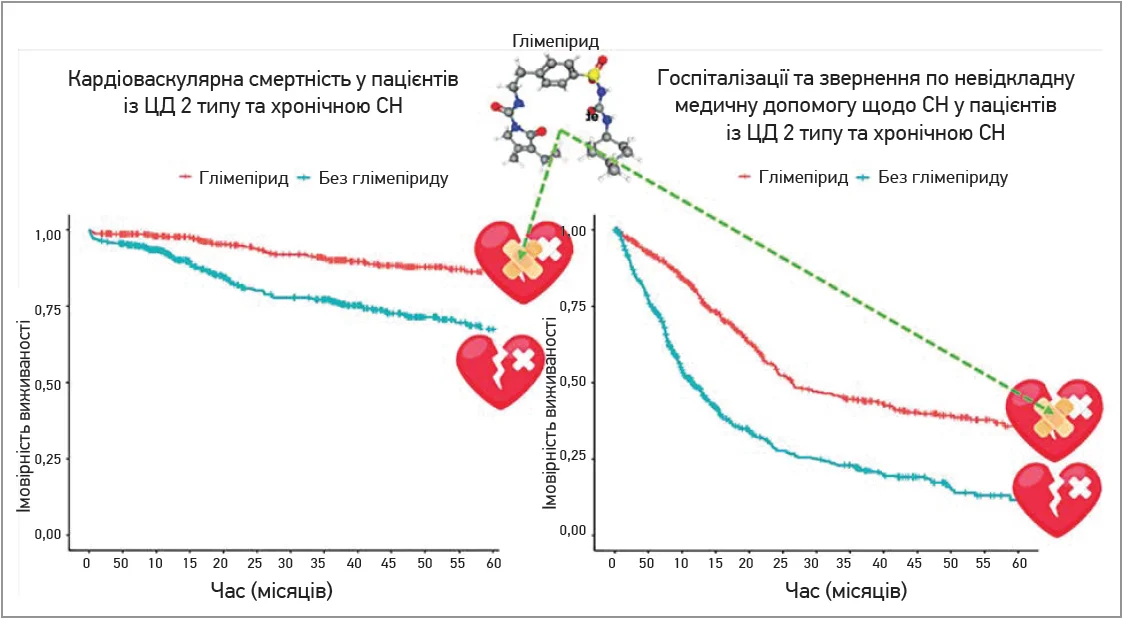 Рис. Сприятливий вплив глімепіриду на перебіг хронічної СН у пацієнтів із ЦД 2 типу
Рис. Сприятливий вплив глімепіриду на перебіг хронічної СН у пацієнтів із ЦД 2 типу
Автори дійшли висновку, що тривале безперервне застосування глімепіриду пов’язано із кращою виживаністю та меншою кількістю кардіоваскулярних катастроф в осіб із ЦД і СН; водночас препарат є економічно доступним. Ці характеристики роблять глімепірид перспективним засобом серед ПСС. Варто зауважити, що медіана віку в групі глімепіриду становила 67 років, тобто значна частка пацієнтів належала до ОЛВ.
За даними метааналізу даних ≈1,5 тис. пацієнтів, глімепіриду властивий нейтральний вплив на масу тіла. Через 12 міс лікування цим препаратом 95% ДІ для змін маси тіла становив від –0,16 кг до +0,21 кг (Bugos C., 2000). Глімепірид також характеризується найнижчим ризиком гіпоглікемій серед усіх ПСС (Basit A. et al., 2012), а його економічна доступність забезпечує цьому препарату важливе місце в лікуванні вітчизняних пацієнтів.
Якщо ПСС, то глімепірид
Отже, з огляду на локальний контекст, значний тягар супутніх захворювань і нижчу (порівняно із середньоєвропейською) тривалість життя, популяція ОЛВ в Україні – це практично люди віком >50 років (або навіть менше).
Для цього контингенту пацієнтів глімепірид може бути ефективним і безпечним другим (на додачу до метформіну) або навіть першим (за непереносимості метформіну) препаратом, який залишається популярним навіть у країнах, де доступні всі нові ПСС й інші протидіабетичні препарати, оскільки забезпечує баланс між ефективністю, безпекою, а також вартістю. Так, за даними японської бази даних Musubi, глімепірид було призначено 80,1% пацієнтів, які отримували ПСС (Yamazaki M. et al., 2024). Глімепірид успішно застосовується як складова подвійної або потрійної глюкозознижувальної терапії, оскільки дієво знижує глікемію з мінімальними побічними ефектами (Sahin I. et al., 2024).
Препарат Олтар® («Берлін-Хемі Менаріні», Німеччина) – глімепірид із максимально широким спектром дозувань: 2, 3, 4 та 6 мг, що надає можливість титрації дози із кроком 1 мг, тобто оптимального персоналізованого ведення пацієнта. Запорука зниження ризику гіпоглікемій, які є серйозною проблемою у віковій групі ОЛВ, – правильний підбір дозування глімепіриду. Призначення препарату Олтар® дозволяє легко розпочати з 1 мг (половина таблетки масою 2 мг) із подальшим підвищенням дози (за потреби). Європейський глімепірид Олтар® забезпечує пацієнтам низку переваг: антигіперглікемічну ефективність, кардіоваскулярну безпеку та покращення прогнозу, легкість і простоту в застосуванні, економічну доступність і відносно низький ризик гіпоглікемій порівняно з іншими представниками цього класу протидіабетичних препаратів.
Підготувала Лариса Стрільчук
Медична газета «Здоров’я України 21 сторіччя» № 2 (588), 2025 р




