26 липня, 2022
Дослідження in vitro дії тайгецикліну в комбінації з амікацином або колістином на карбапенем-резистентні штами Acinetobacter baumannii
Автори цього дослідження вивчали комбіновані схеми антибіотикотерапії (тайгециклін/амікацин і тайгециклін/колістин) для ерадикації карбапенем-резистентних штамів Acinetobacter baumanniі в лабораторних умовах. Під час дослідження встановлено загальну антимікробну чутливість A. baumanniі, чутливість до антибіотиків її штамів, що виділяють різні β-лактамази типу OXA, і синергетичну дію вищенаведених комбінацій антибіотиків.
Ключові слова: карбапенем-резистентні штами Acinetobacter baumanniі, тайгециклін, амікацин, колістин.
A. baumanniі – грамнегативна неферментуюча бактерія роду Brevibacterium, яку переважно виявляють на шкірі та слизових оболонках людини [15]. Вона дуже стійка до дії вологого та теплого середовища, хімічних речовин та ультрафіолетового випромінювання [19]. Життєздатні штами A. baumanniі часто виявляють у лікарнях, особливо на руках медичних працівників, тому ця бактерія є поширеним збудником внутрішньолікарняних інфекцій [5]. Відповідно до результатів ретроспективних досліджень, найпоширенішим інфекційним захворюванням, викликаним A. baumannii, є нозокоміальна пневмонія [3]. Крім того, A. baumannii спричиняє інфекції центральної нервової системи, шкіри та м’яких тканин, кісткової тканини [23]. Інфекційний процес, спричинений мультирезистентними штамами A. baumannii, дуже загрозливий для життя пацієнтів [34]. Саме тому автори наголошують на особливій важливості подальших досліджень A. baumannii, у яких буде вивчено хіміорезистентність цієї бактерії та профілактику викликаних нею захворювань.
Тайгециклін – антибактеріальний препарат, похідне гліцикліну та міноцикліну, що зумовлює його здатність долати більшість механізмів резистентності, сформованих до тетрациклінів [19]. У цьому дослідженні тайгециклін призначали одночасно з колістином або амікацином.
Методи дослідження
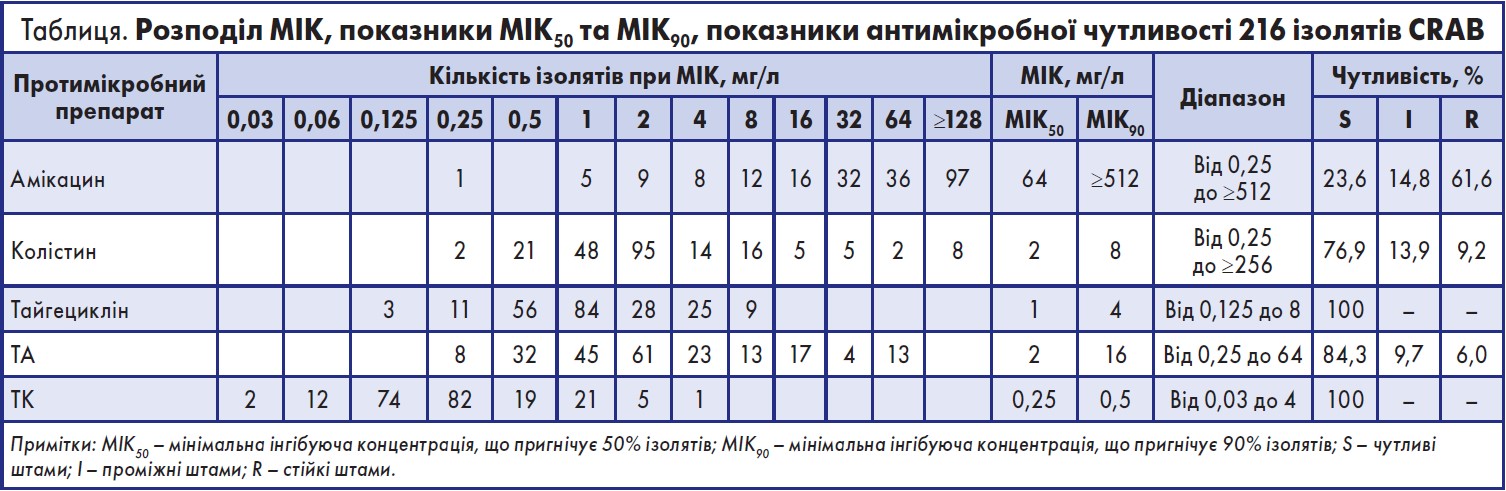
Для дослідження було відібрано та використано 216 ізолятів стійкої до карбапенемів A. baumanniі (carbapenem-resistant A. baumanniі – CRAB). Ці ізоляти CRAB були відібрані з різних частин тіла пацієнтів, які підлягали обстеженню у Клінічній лабораторії впродовж 2018-2020 років. Стійкість A. baumanniі до карбапенемів встановлювали протягом 24 год із моменту відбору зразків [10] із використанням набору Etest. Водночас вчені встановили стійкість ізолятів до інших антибіотиків, зокрема колістину, тайгецикліну та амікацину [10]. Щоб визначити мінімальну інгібуючу концентрацію (МІК) для кожного ізолята A. baumanniі, дослідники застосували метод мікророзведення бульйону. Методи виявлення мікроорганізмів, використані у цьому дослідженні, повністю відповідають Настановам Інституту клінічних та лабораторних стандартів (CLSL) 2015 року [28]. Синергетичну дію антибіотиків, призначених під час цього дослідження, встановили за допомогою шахового розведення [28].
Результати
Антимікробна чутливість
За результатами дослідження, рівень резистентності до амікацину становив 61,6%, МІК50 становила 64, а МІК90 перевищувала 512, що означає розвиток у більшості штамів A. baumannii стійкості до амікацину. Значення МІК50/90 для колістину становили 2/8 мг/л, а показник медикаментозної стійкості – 9,2%, що вказує на те, що невелика кількість A. baumannii розвинула стійкість до колістину. Відповідно значення МІК50/90 для тайгецикліну становили 1/4 мг/л, а рівень медикаментозної чутливості – 100%. Щоб визначити оптимальне співвідношення двох антибіотиків, вчені провели попередній експеримент невеликого масштабу. Для елімінації ізолятів A. baumannii комбінацію тайгецикліну з амікацином використовували у трьох співвідношеннях – 1:9, 1:4 і 1:1. Застосування схеми «тайгециклін/амікацин» (ТА) у співвідношенні 1:1 найбільш ефективно впливало на значення МІК та показники чутливості до антибіотиків. Аналогічне застосування схеми «тайгециклін/колістин» (ТК) у співвідношенні 1:1 найбільш ефективно підвищувало чутливість бактеріальних ізолятів до антибіотиків. Тому для елімінації ізолятів A. baumannii вчені застосовували схеми ТА і ТК у співвідношенні 1:1. Відповідно до таблиці, значення МІК50/90 для ТА становили 2/16 мг/л, натомість як показник стійкості становив 6,0%; значення МІК50/90 для ТК становили 0,25/0,5 мг/л, а показник чутливості до препарату – 100%. Отже, призначення ТК (1:1) може ефективно підвищити чутливість A. baumannii до антибіотиків.
Гени A. baumannii, що кодують β-лактамази типу OXA, та актибактеріальна чутливість A. baumannii
Бета-лактамази оксацилінового спектра (β-лактамази типу OXA) – це клас ферментів, що кодуються генами оксацилінової карбапенемази [30]. Зазвичай цей тип лактамази опосередковує стійкість бактерій до пеніциліну, ефективно гідролізованого клоксациліну, оксациліну та метициліну [30]. Щоб вивчити тип генів A. baumannii, які кодують β-лактамази оксацилінового типу та чутливість бактерії до різних антибіотиків, учені визначили гени оксацилінових β-лактамаз для A. baumannii. Значення МІК50/90 амікацину для ізолятів, що виділяють OXA‑23, становили 128/512 мг/л, а показник медикаментозної стійкості – 68,4%. Значення МІК50/90 для ізолятів, що продукують OXA‑24, становили 128/512 мг/л, а рівень медикаментозної стійкості – 55,9%. Значення МІК50/90 для штамів, що виділяють OXA‑58, становили 64/>512 мг/л, а рівень їхньої стійкості – 50%. Вивчаючи резистентність цих трьох типів бактерій до амікацину, дослідники не встановили статистично значущої різниці. І навпаки, було встановлено значущі відмінності у резистентності до колістину залежно від типу оксацилінової β-лактамази. В ізолятів, що виділяють OXA‑23, виявлено МІК50/90 на рівні 1/2 мг/л, а показник медикаментозної стійкості у них становив 1,3%; в ізолятів, що виділяють OXA‑24, значення МІК50/90 знаходилось на рівні 2/8 мг/л, а показник медикаментозної стійкості сягав 29,4%. Значення МІК50/90 для ізолятів, що продукують OXA‑58, становили 1/4 мг/л, а показник стійкості – 35%. Ізоляти, що виділяють OXA‑24, виявилися більш чутливими до комбінації ТА. На противагу цьому ізоляти, що виділяють OXA‑23, були більш чутливими до схеми ТК.
Синергетичний ефект комбінації тайгецикліну з амікацином або колістином
Після застосування схеми ТА синергізм було виявлено для 103 ізолятів, що становило 47,7% їх загальної кількості (216). Після застосування схеми ТК синергетичний ефект виявлено для 131 ізолята, що становить 71,8% загальної кількості. За результатами цього дослідження доведено синергетичний ефект тайгецикліну, поєднаного з амікацином або колістином.
Обговорення
A. baumannii – це клас оксидазно-негативних грамнегативних кокобактерій, які поширені у природному середовищі й здатні викликати тяжкі госпітальні інфекції [4]. Доведено, що A. baumannii є стійкою до багатьох препаратів і швидко формує гени, які кодують антибіотикорезистентність [32]. У праці M. Gehrleinm et al. (1991) зазначено, що лікування карбапенемами, цефалоспоринами ІІІ покоління та фторхінолонами – незалежний фактор ризику, який сприяє виникненню мультирезистентного штаму A. baumannii [13]. Терапія інфекцій, викликаних A. baumannii, зазвичай супроводжується клінічною дилемою. З одного боку, для початкового емпіричного лікування показані карбапенеми, а з іншого – їх застосування підвищує стійкість до них A. baumannii. Основними ферментами, що відповідають за набуття A. baumannii карбапенем-резистентності, є п’ять підгруп β-лактамаз: OXA‑23, OXA‑40, OXA‑51, OXA‑58 і OXA‑143 [11].
Протягом останніх десятиліть для ерадикації резистентних бактерій та зниження кількості антибіотикостійких штамів застосовують комбіновану антибіотикотерапію. На сьогодні для терапії захворювань, викликаних A. baumannii, призначають комбіновану схему «цефоперазон/сульбактам» [18]. Ефективність такої схеми доведена на практиці, однак для її підтвердження необхідні масштабні клінічні дослідження. M. Gehrleinm et al. (1991) встановили, що 70% мультирезистентних мікроорганізмів чутливі до поліміксину, поєднаного з доксицикліном. До того ж поєднання цих двох антибіотиків має достатню клінічну ефективність у лікуванні інфекцій, викликаних CRAB [13, 24]. W. Santimaleeworagun et al. (2018) довели високий синергетичний ефект сульбактаму, поєднаного з фосфоміцином, що призначали 8 пацієнтам із інфекціями, викликаними CRAB. Ця комбінація є варіантом вибору при захворюваннях, зумовлених CRAB [20].
Тайгециклін – новий антибіотик широкого спектра дії для внутрішньовенного введення. Він зв’язується із субодиницею рибосоми 30S, перешкоджаючи у такий спосіб проникненню аміноацильованих молекул транспортної РНК (тРНК) у рибосомну ділянку А та забезпечуючи подальше інгібування синтезу бактеріального білка [7]. У цьому дослідженні автори довели потужну ерадикаційну дію тайгецикліну на резистентні штами A. baumannii [9]. Чутливість до тайгецикліну 216 ізолятів A. baumannii, відібраних від різних пацієнтів, становила 100%. Однак монотерапія інфекцій, викликаних A. baumannii, може спричинити появу резистентних штамів. Тому автори вивчали комбіноване застосування тайгецикліну й двох інших антибіотиків, амікацину та колістину, для лікування інфекцій, викликаних резистентними штамами A. baumannii. Учені довели, що комбіноване лікування тайгецикліном, поєднаним із амікацином або колістином, посилює токсичну дію препарату на A. baumannii, одночасно підвищуючи її чутливість до амікацину або колістину. До того ж дослідники вперше проаналізували зв’язок між типами генів, що кодують оксацилінові β-лактамази, та стійкістю до тайгецикліну, амікацину й колістину в карбапенем-резистентних штамів A. baumannii. Значення МІК50/90 для ізолятів, що виділяють OXA‑58, становили 4/32 мг/л, а чутливість до препарату – 65%. Значення МІК50/90 для ізолятів, що виділяють OXA‑24, становили 0,5/1 мг/л; водночас показник медикаментозної стійкості був нульовим. Цей результат свідчить, що тайгециклін більш ефективно пригнічує ізоляти A. baumannii, які продукують OXA‑24, ніж ізоляти, що виробляють OXA‑58. Похибка наведеного дослідження зумовлена обмеженим розміром вибірки.
Висновки
Виконавши дослідження in vitro, автори довели дію тайгецикліну, поєднаного з амікацином або колістином, на карбапенем-резистентну A. baumannii. Встановлено також високий синергетичний ефект комбінації тайгецикліну з амікацином або колістином, який проявлявся у підвищенні антибіотикочутливості CRAB. За результатами цього дослідження можлива розробка нових варіантів лікування, спрямованих на подолання стійкості A. baumannii до карбапенемних антибіотиків.
Підготувала Анна Сакалош
За матеріалами: Wu H., Feng H., He L., Zhang H., Xu P. In Vitro Activities of Tigecycline in Combination with Amikacin or Colistin Against Carbapenem-Resistant Acinetobacter baumannii. Appl Biochem Biotechnol. 2021 Dec; 193(12):3867-3876. doi: 10.1007/s12010-021-03664-z. Epub 2021 Sep 15. PMID: 34524633.
PP-TYG-UKR-0020
Надруковано за підтримки Представництва «Пфайзер Експорт Бі. Ві.»