3 грудня, 2021
Методологія впровадження у вітчизняну клінічну практику сучасних міжнародних підходів до діагностики і лікування хронічної загрозливої ішемії нижніх кінцівок
Ведення пацієнтів із хронічною загрозливою ішемією нижніх кінцівок вимагає всестороннього застосування сучасних міжнародних діагностично-лікувальних підходів. У цій статті представлено ретельний аналіз термінів на основі міжнародних дефінітивних документів, розроблені на базі міжнародних настанов діагностичні й лікувальні алгоритми, схеми та таблиці, а також покроковий порядок діагностично-лікувальних дій, що спрямовані на допомогу судинним хірургам і вітчизняним науковцям для оптимізації їхньої клінічної та дослідницької діяльності.
Ключові слова: хронічна загрозлива ішемія нижніх кінцівок, захворювання периферичних артерій нижніх кінцівок, реваскуляризація.
Визначення поняття «хронічна загрозлива ішемія нижніх кінцівок»
У 2019 році під егідою Society for Vascular Surgery, European Society for Vascular Surgery та World Federation of Vascular Societies були опубліковані нові міжнародні настанови щодо діагностики і лікування хронічної загрозливої ішемії нижніх кінцівок (ХЗІНК) під назвою «Глобальні (всесвітні) судинні настанови щодо ведення пацієнтів із хронічною загрозливою ішемією» [1] (далі – «Глобальні судинні настанови»). Це фундаментальна новітня праця, спрямована на уніфікацію міжнародних підходів до діагностично-лікувальної програми при згаданій патології. У документі представлені нові класифікаційні системи ХЗІНК, на основі яких чітко визначаються лікувальні підходи та здійснюються ті чи інші прогнози для пацієнта. Схвалені провідними міжнародними судиннохірургічними товариствами, настанови цього документа дають можливість стандартизувати як клініко-практичну діяльність судинних хірургів різних країн, так і аналіз досягнутих результатів різними науковцями. З огляду на це впровадження згаданих настанов у вітчизняну клінічну й наукову практику є одним із першочергових завдань української судинної хірургії для подальшої активної та продуктивної участі в обговоренні проблеми ХЗІНК на загальносвітовому рівні.
Важливим поштовхом для реалізації цієї мети стало нещодавнє опублікування вітчизняних «Рекомендацій із ведення пацієнтів із хронічною ішемією нижніх кінцівок» [2], де перекладені на українську мову і висвітлені основні положення «Глобальних судинних настанов». Дана ж праця покликана допомогти кожному практикуючому судинному хірургу швидко й легко впровадити зазначені діагностично-лікувальні підходи у клінічну практику.
Насамперед, що таке ХЗІНК? Згідно з вищезгаданими настановами, «хронічна загрозлива ішемія нижніх кінцівок – це клінічний синдром, що визначається наявністю захворювання периферичних артерій (ЗПА) у поєднанні з болем у спокої, гангреною або виразкою нижніх кінцівок тривалістю >2 тижнів» [1].
Але що таке «захворювання периферичних артерій»? В англомовній літературі цьому терміну відповідають два терміни – «peripheral artery disease» та «peripheral artery diseases», які співвідносяться як частина і ціле. У настанові «2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS)» [3] відмінність між цими термінами описана наступним чином: «У цьому документі термін „peripheral artery diseases” охоплює всі артеріальні захворювання, крім коронарних артерій та аорти. Його слід чітко відрізняти від терміну „peripheral artery disease”, який часто використовується для позначення захворювання артерій нижніх кінцівок. А ось інші периферичні артерії, включаючи сонні та хребцеві, артерії верхніх кінцівок, брижові та ниркові артерії… поповнюють сімейство „peripheral artery diseases”. Враховуючи вищесказане, для уникнення непорозумінь, коли ми говоримо про патологію периферичних артерій тільки нижніх кінцівок, на наш погляд, варто вживати термін «захворювання периферичних артерій нижніх кінцівок», відрізняючи його від загального терміну «захворювання периферичних артерій», який включає в себе, крім ЗПА нижніх кінцівок, також захворювання периферичних артерій інших басейнів. До речі, саме таким терміном – «захворювання периферичних артерій нижніх кінцівок» (lower extremity peripheral artery disease) – рекомендовано послуговуватися при описі клінічних досліджень у документі «Оцінка та лікування пацієнтів із захворюванням периферичних артерій нижніх кінцівок: консенсусні визначення від Peripheral Academic Research Consortium (PARC)» [4].
Для правильного розуміння терміну «захворювання периферичних артерій нижніх кінцівок» варто дати відповіді на ще кілька запитань.
Перше запитання: чи включає цей термін гостру патологію артерій нижніх кінцівок? В англомовній літературі за гострою патологією артерій нижніх кінцівок закріплений термін «гостра ішемія кінцівок» («acute limb ischemia») [4], а отже, термін «захворювання периферичних артерій нижніх кінцівок» означає виключно їх хронічну патологію.
Друге питання: чи об’єднує в собі термін «захворювання периферичних артерій нижніх кінцівок» усі їх хронічні захворювання (облітеруючий атеросклероз, облітеруючий ендартеріїт, неспецифічний аортоартеріїт і т.д.), чи стосується лише якогось одного із цих захворювань? На жаль, у міжнародних настановах відповідь на це питання не завжди однозначна. Разом із тим міжнародні дефінітивні документи є одностайними. Зокрема, у вищевказаному документі PARC [4] зазначено: «…захворювання периферичних артерій нижніх кінцівок є проявом системної атеросклеротичної хвороби», а в документі «2012 ACCF/AHA/ACR/SCAI/SIR /STS/SVM/SVN/SVS Основні елементи даних та визначення для периферичних атеросклеротичних судинних захворювань» [5] вказано: «Цей документ містить стандарти даних щодо периферичних атеросклеротичних судинних захворювань (PAVD), включаючи захворювання периферичних артерій нижніх кінцівок (PAD)». І ще: «ЗПА нижніх кінцівок визначається як атеросклеротична хвороба, яка уражує артерії, що живлять нижні кінцівки. Уражені кровоносні судини можуть включати аорту та клубові, стегнові, підколінну, великогомілкові й малогомілкову артерії та їхні основні гілки». Крім того, у розглядуваних нами «Глобальних судинних настановах» щодо ХЗІНК як одного із проявів ЗПА нижніх кінцівок сказано, що її «венозна, травматична, емболічна та неатеросклеротична етіологія – виключаються». На наш погляд, останнє чітко означає, що і для самого ЗПА нижніх кінцівок неатеросклеротична етіологія теж виключається. Підсумовуючи сказане, можемо зробити висновок, що на сьогодні термін «захворювання периферичних артерій нижніх кінцівок» стосується виключно атеросклеротичного процесу.
Ще один аспект заслуговує на увагу. Чи будь-які атеросклеротичні зміни в артеріях нижніх кінцівок можна назвати ЗПА нижніх кінцівок? Безумовно, ні. Щоб виставити такий діагноз, потрібно довести, що ці зміни є гемодинамічно значущими. Найпоширенішим методом доведення цього є визначення кісточково-плечового індексу (КПІ): КПІ <0,9 є ознакою ЗПА нижніх кінцівок. При епідеміологічних дослідженнях частоти цього захворювання його діагноз підтверджують саме на основі КПІ <0,9 [6, 7]. Однак не слід забувати, що при медіакальцинозі (склероз Менкеберга) на фоні цукрового діабету значення КПІ можуть бути суттєво завищеними. Якщо у пацієнта КПІ становить >1,4, то основним показником гемодинамічної значущості атеросклеротичного процесу стає пальце-плечовий індекс (ППІ). Його значення <0,7 знаходяться за межами норми, а отже, свідчать про наявність ЗПА нижніх кінцівок [1]. Ще одним важливим маркером наявності ЗПА є хвилеподібна форма кривої доплерограми артерій нижніх кінцівок [1]. Однак, будучи якісним, цей показник поступається двом вищезгаданим кількісним показникам.
Таким чином, підсумовуючи все вищевикладене, можна дати наступне визначення ЗПА нижніх кінцівок: «Захворювання периферичних артерій нижніх кінцівок – це хронічне атеросклеротичне ураження артерій нижніх кінцівок, основним діагностичним критерієм якого є КПІ <0,9 або поєднання КПІ >1,4 та ППІ <0,7».
Тут слід ще раз наголосити, що в терміні «захворювання периферичних артерій нижніх кінцівок» слово «захворювання» означає одне, а не кілька захворювань. З точки зору мовної коректності замість слова «захворювання» у вищевказаному терміні правильніше було б вживати слово «хвороба», яке звучить по-різному в однині й множині. Слово ж «захворювання» звучить ідентично в однині й множині, і тому не зрозуміло, йдеться про одне чи про кілька захворювань. Це дає привід для термінологічних непорозумінь. Разом із тим у вітчизняній науковій літературі термін «ЗПА» настільки широко вживаний, що в даному документі ми не будемо змінювати традицій і використовуватимемо саме цей термін, утім ще раз наголосивши, що він означає тільки одне (хронічне атеросклеротичне) захворювання.
ЗПА нижніх кінцівок можна розділити на три клінічні форми, лікування кожної з яких кардинально відрізняється:
- асимптомне ЗПА;
- ЗПА з переміжною кульгавістю;
- ХЗІНК.
ХЗІНК включає в себе дві когорти пацієнтів:
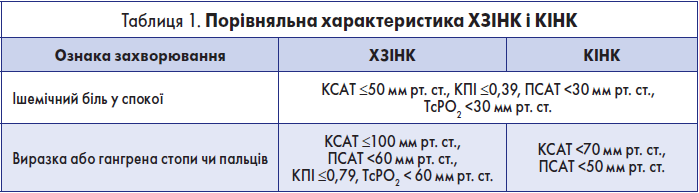
- пацієнти з ішемічним болем у спокої без некротичних змін у кінцівках, щодо яких застосовний хоча б один із наступних критеріїв: кісточковий систолічний артеріальний тиск (КСАТ) ≤50 мм рт. ст., КПІ ≤0,39, пальцьовий систолічний артеріальний тиск (ПСАТ) <30 мм рт. ст., транскутанний парціальний тиск кисню (TcPO2) <30 мм рт. ст.;
- пацієнти із некротичними змінами у кінцівках, щодо яких застосовний хоча б один із наступних критеріїв: КПІ ≤0,79, КСАТ ≤100 мм рт. ст., ПСАТ <60 мм рт. ст., TcPО2 <60 мм рт. ст. [1].
Раніше у міжнародних настановах широковживаним було поняття «критична ішемія нижніх кінцівок (КІНК)», але з появою поняття «хронічна загрозлива ішемія нижніх кінцівок» цей термін більше не рекомендований до вжитку. Але чим відрізняються ці два поняття? У 1982 робоча група судинних хірургів визначила КІНК як ішемічний біль у спокої з кісточковим тиском <40 мм рт. ст. або некроз тканин із кісточковим тиском <60 мм рт. ст. у пацієнтів без цукрового діабету [8]. Із часом це поняття зазнало змін. У документі TASC II 2007 року вказано наступне: «Ішемічний біль у спокої найчастіше виникає при кісточковому тиску 50 мм рт. ст. або пальцьовому тиску менше 30 мм рт. ст. … Для пацієнтів із виразкою або гангреною наявність КІНК свідчить про кісточковий тиск менше 70 мм рт. ст. або систолічний пальцьовий тиск менше 50 мм рт. ст. (Важливо розуміти, що немає повного консенсусу щодо судинних гемодинамічних параметрів, необхідних для встановлення діагнозу КІНК.)» [9].
Таким чином, як і ХЗІНК, КІНК включала абсолютно ідентичних до ХЗІНК пацієнтів з ішемічним болем у спокої без некротичних змін у кінцівках, а також пацієнтів із такими змінами, у яких КСАТ становив ≤70 мм рт. ст. і ПСАТ ≤50 мм рт. ст.
Враховуючи це, поняття ХЗІНК є ширшим, ніж поняття КІНК. ХЗІНК охоплює всіх пацієнтів із КІНК плюс пацієнтів із некротичними змінами у кінцівках із КСАТ у межах 70-100 мм рт. ст. і ПСАТ у межах 50-60 мм рт. ст.
Охоплення терміном ХЗІНК ширшої когорти пацієнтів дає можливість вчасно виявити загрозу для нижніх кінцівок і швидше запропонувати пацієнту реваскуляризацію, що дозволяє зупинити некротичний процес і сприяє найефективнішому загоєнню тканинних дефектів. Порівняльна характеристика ХЗІНК і КІНК представлена у табл. 1.
Встановлення всіх пунктів діагнозу для подальшого вибору лікувальної тактики
Після підтвердження у хворого діагнозу ХЗІНК для вибору подальшої лікувальної тактики слід здійснити три важливі діагностичні кроки.
Крок 1. Оцінка ураженої кінцівки за класифікацією WIfI (2014) [10]
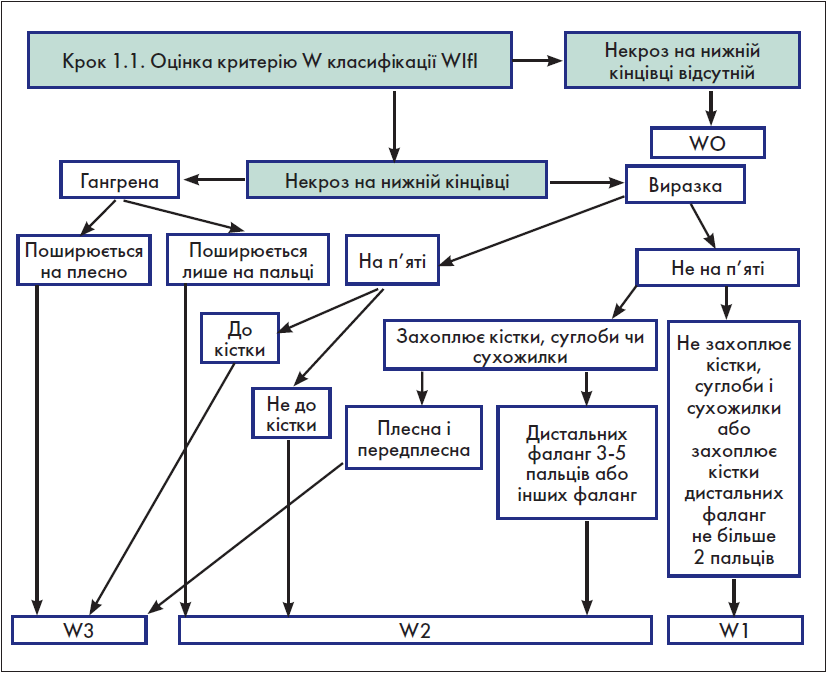
Крок 1.1. Оцінка критерію W (рана) класифікації WІfI
Для оцінки критерію W класифікації WІfI в оригінальному документі [1] запропонована таблиця, яка, на жаль, є досить громіздкою і використання якої потребує значних затрат часу. З огляду на це на основі вищезгаданої таблиці нами розроблено власний алгоритм, який дозволяє оцінити критерій W значно швидше (рис. 1).
Рис. 1. Оцінка критерію W класифікації WІfI
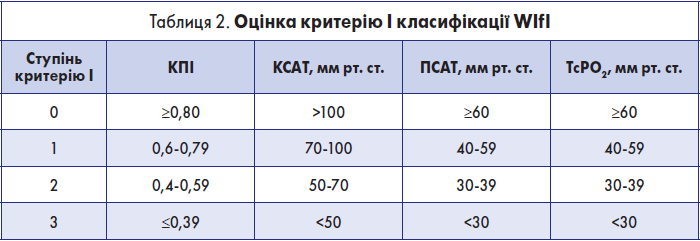
Крок 1.2. Оцінка критерію І (ішемія) класифікації WІfI
Оцінка цього критерію здійснюється за табл. 2.
У пацієнтів без цукрового діабету і з КПІ ≤1,3 оцінку критерію І можна здійснювати за КПІ. У пацієнтів із цукровим діабетом та КПІ >1,3 слід вимірювати і ПСАТ. Якщо ПСАТ і КПІ вказують на різні ступені критерію І, але ПСАТ вважається основним показником, який визначає ступінь ішемії. Якщо артеріальна кальцифікація перешкоджає надійному вимірюванню і КПІ, і ПСАТ, ступінь ішемії слід визначати за допомогою TcPО2.
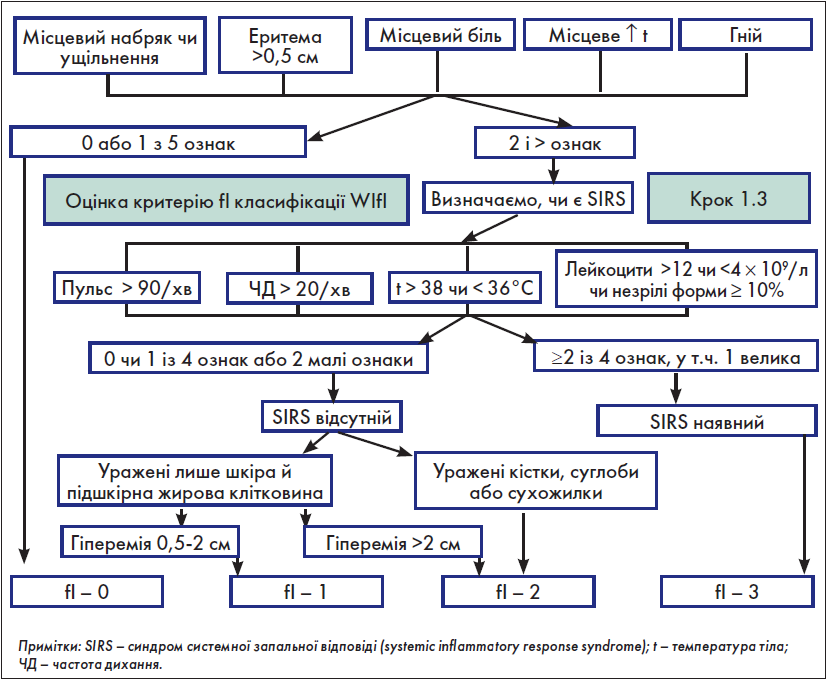
Крок 1.3. Оцінка критерію fІ (інфекція стопи) класифікації WІfI
Як і для критерію W, використання таблиці для оцінки критерію fІ з оригінального документа потребує значних затрат часу. З огляду на це на основі вищевказаної таблиці нами розроблено власний алгоритм швидкої оцінки критерію fІ (рис. 2).
Рис. 2. Оцінка критерію fІ класифікації WІfI
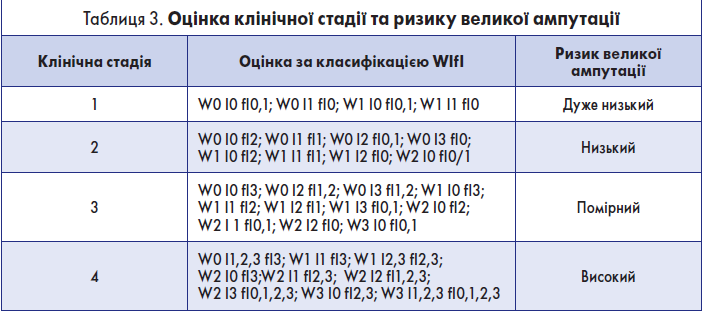
Крок 1.4. Оцінка клінічної стадії та ризику великої (вище кісточки) ампутації в межах 1 року
Ця оцінка здійснюється на основі табл. 3.
Якщо стопу врятувати неможливо, констатують клінічну стадію 5.
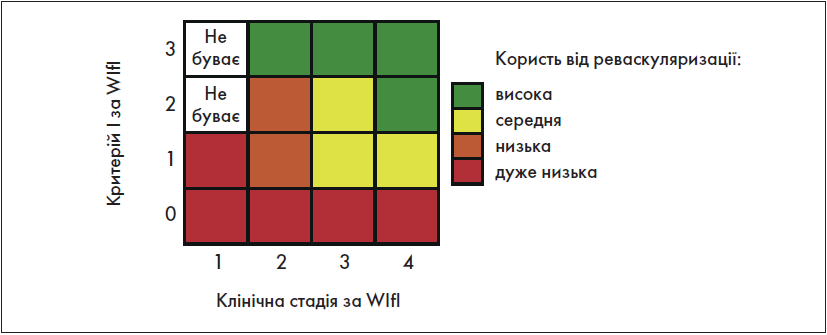
Крок 1.5. Оцінка користі від імовірної реконструктивної операції
В оригінальній публікації, яка присвячена класифікації WІfI [10], зазначена оцінка здійснюється на основі зіставлення трьох критеріїв цієї класифікації. Але у «Глобальних судинних настановах» рекомендована оцінка, зображена на рис. 3.
Рис. 3. Оцінка користі від імовірної реконструктивної операції
Крок 2. Оцінка ступеня хірургічного ризику
У «Глобальних судинних настановах» пропонуються лише два ступені хірургічного ризику: помірний і високий. Ці ступені встановлюються на підставі визначення перипроцедуральної смертності та дворічної виживаності.
Постає питання: як оцінити очікувану перипроцедуральну смертність та дворічну виживаність? У «Глобальних судинних настановах» чітких рекомендацій щодо цього немає: рекомендуються різні шкали на розсуд лікаря, який виставляє діагноз. У цій статті ми опишемо лише по одній шкалі для оцінки кожного із двох вищезазначених показників, які нам вбачаються як найбільш практичні [11, 12]. Разом із тим судинний хірург-практик має право скористатися й іншими шкалами [13-18].
Крок 2.1. Оцінка перипроцедуральної смертності
Перипроцедуральна смертність – це смертність у терміні до 30 діб після оперативного втручання. Вона може бути оцінена за шкалою CRAB [11] (табл. 4).
Згідно з цією шкалою перипроцедуральна смертність становить >5%, якщо загальна кількість балів ≥7.
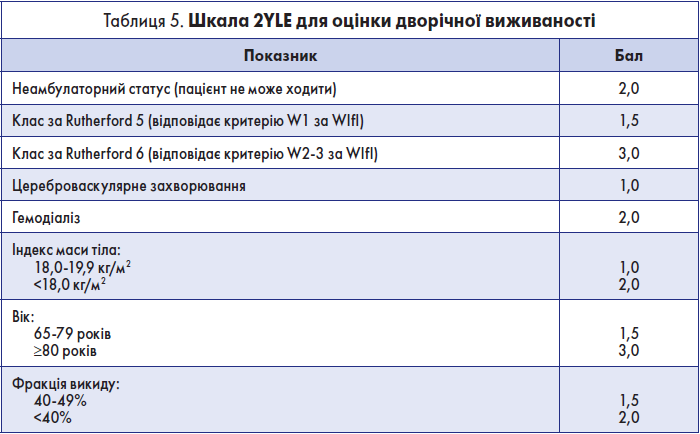
Крок 2.2. Оцінка дворічної виживаності
Цей показник можна оцінити на основі шкали 2YLE [12] (табл. 5).
Згідно з цією шкалою, дворічна виживаність становить <50% при загальній кількості балів ≥8.
Крок 2.3. Кінцева оцінка ступеня хірургічного ризику
- Хірургічний ризик є помірним – якщо очікувана перипроцедуральна смертність становить <5%, а дворічна виживаність >50%.
- Хірургічний ризик є високим – якщо очікувана перипроцедуральна смертність становить >5% або дворічна виживаність <50%.
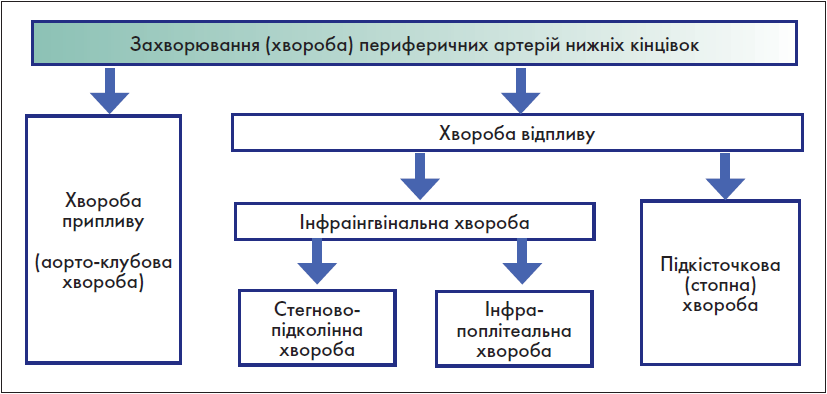
Крок 3. Класифікація анатомічних уражень артерій нижніх кінцівок
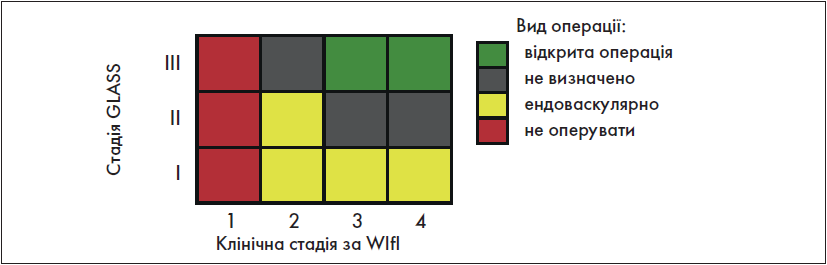
Цей пункт діагностики здійснюється на основі глобальної (всесвітньої) класифікаційної системи анатомічних змін артерій нижніх кінцівок GLASS (the Global Limb Anatomic Staging System). Згідно з цією системою, ЗПА нижніх кінцівок поділяється на хворобу припливу (аорто-клубову хворобу) та хворобу відпливу. Хвороба відпливу, у свою чергу, включає: стегново-підколінну, інфрапоплітеальну та підкісточкову (інфрамалеолярну) хвороби. Існує також термін «інфраінгвінальна хвороба». Щодо цього терміну у «Глобальних судинних настановах» наявні певні розбіжності: подекуди у тексті цього документу вказаний термін збігається з терміном «хвороба відпливу», але найчастіше він поєднує у собі лише стегново-підколінну та інфрапоплітеальну хвороби. Керуючись останнім, взаємовідношення між усіма вищезазначеними термінами можна представити у вигляді схеми (рис. 4).
Рис. 4. Анатомічний поділ ЗПА нижніх кінцівок за GLASS
Кожній із вказаних хвороб відповідають ті чи інші артеріальні сегменти нижньої кінцівки. Таким чином, система GLASS поділяє артерії нижньої кінцівки на чотири сегменти:
1) аорто-клубовий:
– аорта;
– загальна клубова артерія;
– зовнішня клубова артерія;
– внутрішня клубова артерія;
– загальна стегнова артерія;
– глибока стегнова артерія;
2) стегново-підколінний:
– поверхнева стегнова артерія;
– підколінна артерія;
3) інфрапоплітеальний:
– тібіоперонеальний стовбур;
– передня великогомілкова артерія;
– задня великогомілкова артерія проксимальніше рівня медіальної (присередньої) кісточки;
– малогомілкова артерія проксимальніше рівня медіальної кісточки;
4) підкісточковий (стопний):
– артерія тилу стопи;
– задня великогомілкова артерія дистальніше рівня медіальної (присередньої) кісточки;
– малогомілкова артерія дистальніше рівня медіальної кісточки.
У системі GLASS передбачена окрема класифікація уражень кожного з вищевказаних сегментів.
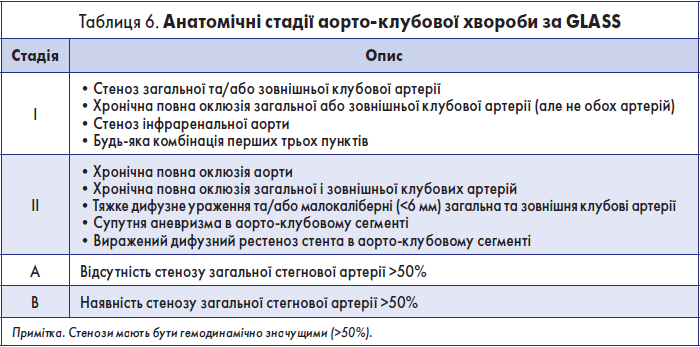
Крок 3.1. Визначення анатомічної стадії аорто-клубової хвороби за GLASS
Розрізняють чотири анатомічні стадії аорто-клубової хвороби: ІА, ІВ, ІІА, ІІВ. Характеристики кожної зі стадій наведені у табл. 6.
Крок 3.2. Визначення анатомічної стадії інфраінгвінальної хвороби за GLASS
Крок 3.2.1. Окреслення цільового артеріального шляху
Цільовий артеріальний шлях (ЦАШ) – це безперервний маршрут від паху до кісточок, який, як правило, включає у себе найменш уражену артерію інфрапоплітеального сегмента, але може ґрунтуватися на принципі ангіосом (тобто можна обрати не найменш уражену артерію інфрапоплітеального сегмента, а ту, що кровопостачає ділянку стопи або гомілки з некрозом).
Крок 3.2.2. Визначення ступеня ураження стегново-підколінного сегмента (табл. 7).
Крок 3.2.3. Визначення ступеня ураження інфрапоплітеального сегмента (табл. 8).
Слід зауважити, що все описане в табл. 8 стосується лише інфрапоплітеальної артерії цільового артеріального шляху. Інші інфрапоплітеальні артерії можуть бути тотально оклюзовані, але це не впливає на ступінь ураження інфрапоплітеального сегмента.
Крок 3.2.4. Оцінка кальцифікації артерій цільового артеріального шляху у стегново-підколінному та інфрапоплітеальному сегментах
На цьому кроці слід встановити, чи наявна сильна кальцифікація (наприклад, >50% окружності; дифузні, об’ємні бляшки або бляшки типу «кораловий риф») у стегново-підколінному та інфрапоплітеальному сегментах цільового артеріального шляху). Якщо наявні, то ступінь(ені) ураження сегмента(ів) слід збільшити на 1 бал (крім 4-го ступеня, який залишиться незмінним).
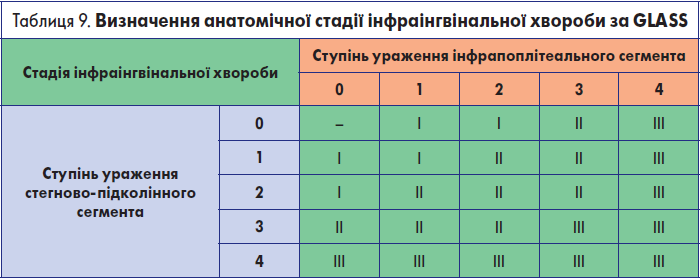
Крок 3.2.5. Остаточне визначення анатомічної стадії інфраінгвінальної хвороби за GLASS
Виділяють три анатомічні стадії інфраінгвінальної хвороби: І, ІІ і ІІІ. Їх визначення здійснюється на основі зіставлення ступенів ураження стегново-підколінного та інфрапоплітеального артеріальних сегментів (табл. 9).
Анатомічна стадія інфраінгвінальної хвороби за GLASS не лише визначає подальшу хірургічну тактику, а й дозволяє спрогнозувати імовірність технічного неуспіху реваскуляризації та відсоток функціонування зони реконструкції впродовж 1 року. Так, для І стадії ці показники становлять відповідно <10% та >70%, для ІІ – 10-20% та 50-70%, для ІІІ – >20% та <50%.
Крок 3.3. Встановлення дескриптора підкісточкової (стопної) хвороби
Розрізняють наступні варіанти ураження артерій підкісточкового артеріального сегмента (табл. 10).
Крок 3 є завершальним у діагностичній програмі. Після нього можна чітко сформулювати діагноз у пацієнта. Приклад такого діагнозу: «ЗПА, ХЗІНК; W1 I3 fI1, клінічна стадія 3, хірургічний ризик – помірний; GLASS: аорто-клубова хвороба – ІІВ, інфраінгвінальна хвороба – ІІІ (стегново-підколінна хвороба – 4, інфрапоплітеальна хвороба – 3), підкісточкова хвороба – Р1».
Після завершення класифікаційного процесу, крім пунктів діагнозу, ми отримуємо також певні показники, які важливі для прогнозування результату лікування, а також для пояснення пацієнту складності його патології. Для прикладу, вищевказаному діагнозу можуть відповідати такі значення згаданих показників:
- ризик ампутації в межах 1 року – помірний;
- користь від реваскуляризації – висока;
- перипроцедуральна смертність <5%;
- дворічна виживаність >50%;
- ймовірність технічного неуспіху реваскуляризації >20%;
- відсоток функціонування зони реконструкції впродовж 1 року <50%.
Вибір хірургічної тактики
Згідно із «Глобальними судинними настановами», вибір хірургічної тактики чітко залежить від встановлених нами вищерозглянутих пунктів діагнозу.
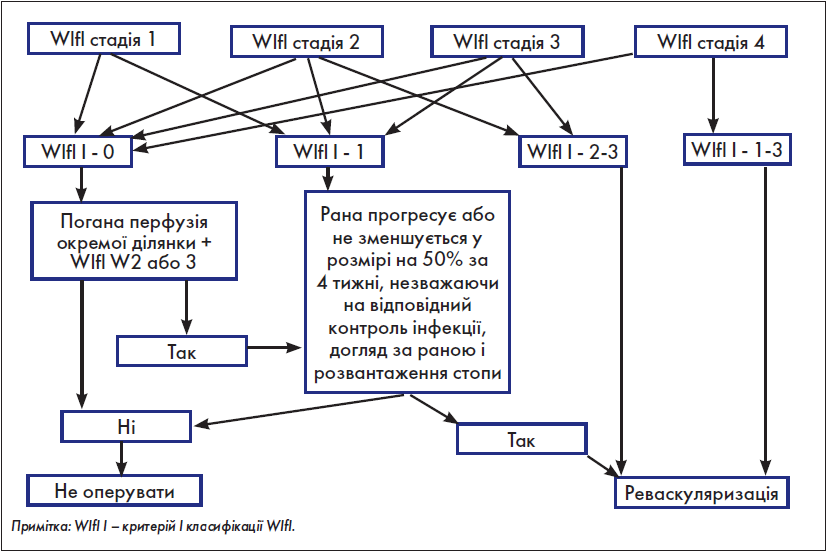
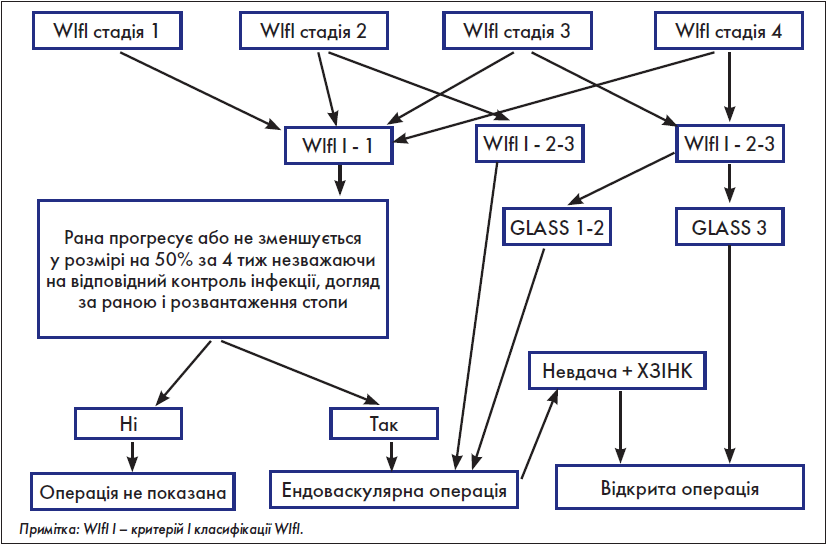
Крок 4. Оцінка необхідності здійснення реваскуляризації
У «Глобальних судинних настановах» із цього приводу є ряд рекомендацій, які для швидкого аналізу практичним хірургом були об’єднані нами у розробленій з цією метою схемі (рис. 5).
Рис. 5. Оцінка необхідності виконання реваскуляризації
Якщо реваскуляризація не показана – проводимо консервативне лікування; якщо ж показана – переходимо до наступного кроку.
Крок 5. Вибір оптимального методу реваскуляризації
Згідно із «Глобальними судинними настановами», такий вибір має ґрунтуватися виключно на даних доказової медицини, а отже, реваскуляризація має бути науково обґрунтованою. Вибір методу реваскуляризації здійснюється окремо для аорто-клубової та інфраінгвінальної хвороб.
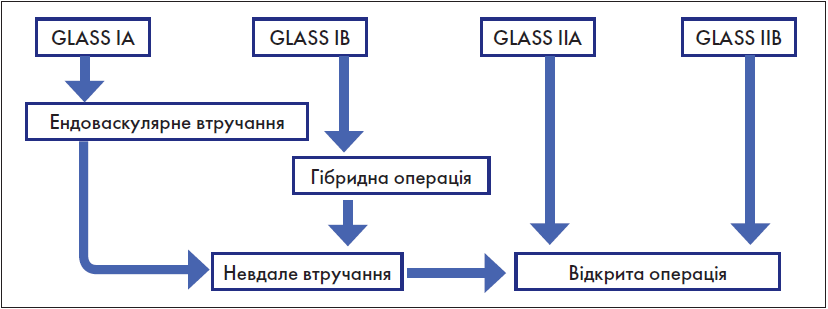
Крок 5.1. Вибір оптимального методу реваскуляризації аорто-клубового сегмента
Основні підходи до цього питання у «Глобальних судинних настановах» акумульовані нами у нижченаведеній схемі (рис. 6).
Рис. 6. Вибір оптимального методу реваскуляризації аорто-клубового сегмента
Схема, представлена на рис. 6, визначає лише основні, концептуальні, підходи. Що ж до конкретних видів ендоваскулярних або відкритих втручань, а також винятків із зазначеної схеми, то вони у повному обсязі представлені у «Рекомендаціях з ведення пацієнтів із хронічною ішемією нижніх кінцівок» [2].
Крок 5.2. Вибір оптимального методу реваскуляризації при інфраінгвінальній хворобі
Такий вибір грунтується на запропонованому авторами «Глобальних судинних настанов» трикроковому інтегрованому підході – PLAN (Patient risk estimation, Limb staging, ANatomic pattern of disease).
PLAN-підхід передбачає врахування при виборі оптимального методу реваскуляризації таких трьох моментів, як:
- хірургічний ризик у пацієнта;
- характеристика кінцівки за WIfI-класифікацією;
- анатомічні зміни артерій нижніх кінцівок за класифікаційною системою GLASS.
Згідно із PLAN-підхoдом, вибір оптимального методу реваскуляризації при інфраінгвінальній хворобі здійснюється по-різному у пацієнтів із помірним та високим хірургічним ризиком.
Крок 5.2.1. Вибір оптимального методу реваскуляризації при інфраінгвінальній хворобі у пацієнтів із помірним хірургічним ризиком
Здійснюється за схемою, представленою на рис. 7.
Рис. 7. Вибір оптимального методу реваскуляризації при інфраінгвінальній хворобі у пацієнтів із помірним хірургічним ризиком
Як видно зі схеми, щодо деяких категорій пацієнтів (стадія GLASS ІІ при клінічній стадії за WIfI 3 або 4; стадія GLASS ІІІ при клінічній стадії за WІfI 2) на сьогодні немає доказової бази, щоб рекомендувати відкрите чи ендоваскулярне втручання. У цих пацієнтів можна використати як перший, так і другий метод після діагностичної оцінки кожного хворого індивідуально.
Крок 5.2.2. Вибір оптимального методу реваскуляризації при інфраінгвінальній хворобі у пацієнтів із високим хірургічним ризиком
Для таких хворих у «Глобальних судинних настановах» містяться численні рекомендації, синтезовані нами у нижченаведеній схемі (рис. 8).
Рис. 8. Вибір оптимального методу реваскуляризації при інфраінгвінальній хворобі у пацієнтів із високим хірургічним ризиком
Крок 5.3. Вибір хірургічної тактики при одномоментному ураженні аорто-клубового та інфраінгвінального сегментів
Щодо таких випадків, то у «Глобальних судинних настановах» зустрічаємо ряд рекомендацій:
1) корекцію лише хвороби припливу здійснювати в осіб із:
– ішемією низького ступеня (І1 за WIfI);
– обмеженою втратою тканини (W0/1 за WIfI);
– за будь-яких обставин, при яких співвідношення «ризик/користь» від додаткового відтоку високе або спочатку не ясне;
2) одночасну реваскуляризацію припливу та відпливу розглянути у пацієнтів:
– із високим ризиком для кінцівок (клінічна стадія за WIfI 3 або 4);
– із вираженою ішемією (критерій І за WIfI 2 або 3);
3) рішення щодо поетапної чи одномоментної реваскуляризації припливу та відпливу приймати на підставі оцінки хірургічного ризику у пацієнта та ступеня загрози для кінцівки (клінічна стадія за WIfI);
4) ліквідовувати захворювання припливу першочергово;
5) після проведення корекції припливу повторно визначити клінічну стадію за WIfI та стадію інфраінгвінальної хвороби за GLASS.
Що ж до самої хвороби відпливу, то при одночасних ураженнях стегново-підколінного та інфрапоплітеального артеріальних сегментів перевагу слід віддавати їх одномоментній реваскуляризації, натомість для уражень підкісточкового сегмента науково обґрунтованих доказів щодо вибору хірургічної тактики на сьогодні не існує.
Корекція чинників ризику та медикаментозне лікування
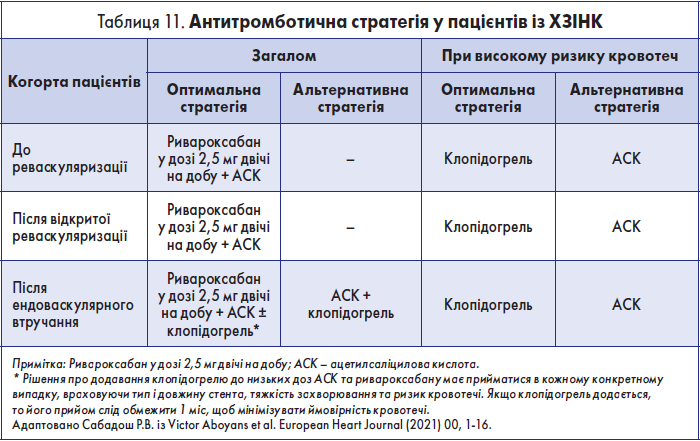
Корекція чинників ризику та до- й післяопераційне медикаментозне лікування пацієнтів із ХЗІНК, які пропонуються у «Глобальних судинних настановах», детально висвітлені у вищезгадуваних вітчизняних рекомендаціях [2]. Ця стаття не має на меті дублювати зазначену інформацію. Єдине, на чому доцільно зупинитися, – це антитромботична терапія, оскільки у 2021 році опубліковано новий консенсусний документ ESC (European Society of Cardiology), у якому висвітлені найновіші дані щодо цього питання. У настановах ESC розглянута оптимальна та альтернативна антитромботична терапія в осіб із симптомним ЗПА нижніх кінцівок (у т.ч. із ХЗІНК) як до, так і після відкритої або ендоваскулярної реваскуляризації (загалом та при високому ризику кровотеч) [19]. Зазначені рекомендації можна представити у вигляді табл. 11.
Як видно з таблиці, загалом оптимальною стратегією у пацієнтів із ХЗІНК як до реваскуляризації, так і після відкритого або ендоваскулярного втручання є поєднання ривароксабану у дозі 2,5 мг двічі на добу з низькими дозами ацетилсаліцилової кислоти (АСК), хоча після ендоваскулярних операцій у частини пацієнтів прийом зазначених препаратів варто поєднати на 1 місяць із клопідогрелем. Що ж до осіб із високим ризиком кровотечі, то оптимальною стратегією у них як до, так і після відкритого або ендоваскулярного втручання визнано призначення клопідогрелю. Тут слід зазначити, що до осіб із високим ризиком кровотечі у вказаному документі віднесено пацієнтів, у яких наявні: «внутрішньочерепна кровотеча в анамнезі, або ішемічний інсульт, або інша внутрішньочерепна патологія, нещодавня шлунково-кишкова кровотеча або анемія через можливу втрату крові зі шлунково-кишкового тракту, інша шлунково-кишкова патологія, пов’язана з підвищеним ризиком кровотечі, печінкова недостатність, геморагічний діатез або коагулопатія, глибока старість або слабкість чи ниркова недостатність зі швидкістю клубочкової фільтрації <15 мл/хв/1,73 м2.
Висновки
Впровадження нових міжнародних діагностично-лікувальних підходів щодо пацієнтів із ХЗІНК у вітчизняну клінічну й наукову практику важко переоцінити. Однак складність різноманітних класифікаційних систем, суперечливість деяких лікувальних підходів, а також численні термінологічні невідповідності у різних міжнародних настановах значно ускладнюють це важливе завдання для української судинної хірургії. Представлені нами ретельний аналіз термінів на основі міжнародних дефінітивних документів, розроблені на базі міжнародних настанов діагностичні й лікувальні алгоритми, а також покрокова схема діагностично-лікувальних дій спрямовані на допомогу як практичному судинному хірургу, так і вітчизняним науковцям для оптимізації їхньої клінічної та дослідницької діяльності з можливістю інтеграції в міжнародний судиннохірургічний простір.
Література
- Conte M.S., Bradbury A.W., Kolh P. et al. Global vascular guidelines on the management of chronic limb-threatening ischemia. J Vasc Surg. 2019;69(6S):3S‑125S.
- Рекомендації з ведення пацієнтів із хронічною ішемією нижніх кінцівок / За ред. П.І. Нікульнікова, І.М. Гудза, Ю.Г. Орла і А.В. Ратушнюка // Здоров’я України, 2021;1(43):8-18.
- Aboyans V., Ricco J.B., Bartelink M.E.L., Bjorck M., Brodmann M., Cohnert T., Collet J.P., Czerny M., De Carlo M., Debus S., Espinola-Klein C., Kahan T., Kownator S., Mazzolai L., Naylor A.R., Roffi M., Rother J., Sprynger M., Tendera M., Tepe G., Venermo M., Vlachopoulos C., Desormais I.; ESC Scientific Document Group. 2017 ESC Guidelines on the Diagnosis and Treatment of Peripheral Arterial Diseases, in collaboration with the European Society for Vascular Surgery (ESVS). Eur Heart J 2018;39:763-816.
- Patel M.R., Conte M.S., Cutlip D.E., Dib N., Geraghty P., Gray W. et al. Evaluation and treatment of patients with lower extremity peripheral artery disease: consensus de fi nitions from Peripheral Academic Research Consortium (PARC). J Am Coll Cardiol 2015;65:931-41.
- Writing Committee to Develop Clinical Data Standards for Peripheral Atherosclerotic Vascular Diseases, Creager M.A., Belkin M. et al., 2012 ACCF/AHA/ACR/SCAI/SIR/STS/SVM/SVN/SVS Key Data Elements and Definitions for Peripheral Atherosclerotic Vascular Disease. A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Clinical Data Standards (Writing Committee to Develop Clinical Data Standards for Peripheral Atherosclerotic Vascular Disease). Circulation. 2012;125:395-467.
- Kojima I., Ninomiya T., Hata J., Fukuhara M., Hirakawa Y., Mukai N. et al. A low ankle brachial index is associated with an increased risk of cardiovascular disease: the Hisayama study. J Atheroscler Thromb 2014;21:966-73.
- Sheng C.S., Li Y., Huang Q.F., Kang Y.Y., Li F.K., Wang J.G. Pulse waves in the lower extremities as a diagnostic tool of peripheral arterial disease and predictor of mortality in elderly Chinese. Hypertension 2016;67:527-34.
- Bell P. The definition of critical ischaemia of a limb. Br J Surg 1982; 69: S2.
- Norgren L., Hiatt WR, Dormandy J.A., Nehler M.R., Harris K.A., Fowkes F.G. Inter-society consensus for the management of peripheral arterial disease (TASC II). J Vasc Surg 2007;45(Suppl. S): S5 e 67.
- Mills J.L. Sr, Conte M.S., Armstrong D.G., Pomposelli F.B., Schanzer A., Sidawy A.N. et al. The Society for Vascular Surgery Lower Extremity Threatened Limb Classi fi cation System: risk strati fi cation based on wound, ischemia, and foot infection (WIfI). J Vasc Surg 2014;59:220-34.e1-2.
- Meltzer A.J., Graham A., Connolly P.H., Meltzer E.C., Karwowski J.K., Bush H.L. et al. The Comprehensive Risk Assessment for Bypass (CRAB) facilitates ef fi cient perioperative risk assessment for patients with critical limb ischemia. J Vasc Surg 2013;57:1186-95.
- Soga Y., Iida O., Takahaera M., Hirano K., Suzuki K., Kawasaki D. et al. Two-year life expectancy in patients with critical limb ischemia. JACC Cardiovasc Interv 2014;7:1444-9.
- Biancari F., Salenius J.P., Heikkinen M., Luther M., Ylonen K., Lepantalo M. Risk-scoring method for prediction of 30-day postoperative outcome after infrainguinal surgical revascularization for critical lower-limb ischemia: a Finn-vasc registry study. World J Surg 2007;31:217-25; discussion: 226-7.
- Schanzer A., Mega J., Meadows J., Samson R.H., Bandyk D.F., Conte M.S. Risk strati fi cation in critical limb ischemia: derivation and validation of a model to predict amputation-free survival using multicenter surgical outcomes data. J Vasc Surg 2008;48:1464-71.
- Bradbury A.W., Adam D.J., Bell J., Forbes J.F., Fowkes F.G., Gillespie I. et al. Bypass versus Angioplasty in Severe Ischaemia of the Leg (BASIL) trial: a survival prediction model to facilitate clinical decision making. J Vasc Surg 2010;51(Suppl):52S‑68S.
- Simons J.P., Goodney P.P., Flahive J., Hoel A.W., Hallett J.W., Kraiss L.W. et al. A comparative evaluation of risk-adjustment models for benchmarking amputation-free survival after lower extremity bypass. J Vasc Surg 2016;63: 990-7.
- Taylor S.M., Kalbaugh C.A., Blackhurst D.W., Cass A..L, Trent E.A., Langan E.M. et al. Determinants of functional outcome after revascularization for critical limb ischemia: an analysis of 1000 consecutive vascular interventions. J Vasc Surg 2006;44:747-55; discussion: 755-6.
- Simons J.P., Schanzer A., Flahive J.M., Osborne N.H., Mills J.L. Sr., Bradbury A.W. et al. Survival prediction in patients with chronic limb-threatening ischemia who undergo infrainguinal revascularization. J Vasc Surg 2018 Nov 26. [Epub ahead of print].
- Aboyans V., Bauersachs R., Mazzolai L., Brodmann M., Palomares J.F.R., Debus S., Collet J.P., Drexel H., Espinola-Klein C., Lewis B.S., Roffi M., Sibbing D., Sillesen H., Stabile E., Schlager O., De Carlo M. Antithrombotic therapies in aortic and peripheral arterial diseases in 2021: a consensus document from the ESC working group on aorta and peripheral vascular diseases, the ESC working group on thrombosis, and the ESC working group on cardiovascular pharmacotherapy. Eur Heart J 2021;42:4013-4024.