18 квітня, 2025
Оновлені дані щодо менеджменту чоловічого безпліддя
Рекомендації Американської урологічної асоціації та Американського товариства репродуктивної медицини 2024 року
У 2023 році Американська урологічна асоціація (AUA) запросила оновлений огляд літератури, щоб включити нові дані, отримані після публікації цієї настанови у 2020 році. Як результат, у 2024 році було внесено зміни з урахуванням оновлених рекомендацій щодо належного обстеження та лікування чоловіка-партнера у безплідній парі. У представленому документі міститься кілька оновлень, включаючи переглянуті порогові значення для тестування на мікроделецію Y-хромосоми, показання до магнітно-резонансної томографії (МРТ) органів малого таза у чоловіків із безпліддям, а також рекомендації щодо використання тестикулярної сперми у чоловіків без азооспермії. Ця настанова потребуватиме подальшого перегляду, оскільки діагностичні й лікувальні можливості в цій галузі продовжують розвиватися.
Ключові слова: чоловіче безпліддя, чоловіча фертильність, спермограма, азооспермія, екстракорпоральне запліднення, допоміжні репродуктивні технології, внутрішньоматкова інсемінація, інтрацитоплазматична ін’єкція сперматозоїдів, мікроделеція Y-хромосоми, ідіопатичний гіпогонадотропний гіпогонадизм.
У приблизно половині випадків безплідних пар причиною безпліддя є повністю або частково чоловічий фактор. Хоча багато пар можуть досягти вагітності за допомогою внутрішньоматкової інсемінації (ВМІ) та допоміжних репродуктивних технологій (ДРТ) (екстракорпоральне запліднення [ЕКЗ] з/без інтрацитоплазматичної ін’єкції сперматозоїдів [ІКСІ]), обстеження чоловіків є важливою для найточнішого підбору терапії. Чоловіче безпліддя зазвичай діагностується за одним або кількома факторами, які можуть включати: аномальну якість сперми або порушення її функціональних параметрів; анатомічні, ендокринні, генетичні, функціональні або імунологічні аномалії чоловічої репродуктивної системи; сексуальні розлади, не сумісні з можливістю потрапляння сперми в піхву.
Основні терміни спермограми визначено в табл. 1 [1, 2]. Короткий виклад діагностичних та лікувальних рекомендацій представлено у вигляді алгоритму (рисунок).
|
Таблиця 1. Основні терміни спермограми* |
|
|
Термін |
Визначення |
|
Аспермія |
Повна відсутність сперматозоїдів в еякуляті, що вказує на відсутність вироблення сім’яної рідини або обструкції у статевих шляхах |
|
Азооспермія |
Відсутність сперматозоїдів у спермі, що зазвичай є наслідком обструкції в генітальному тракті (обструктивна азооспермія) або дисфункції утворення сперматозоїдів (необструктивна азооспермія) |
|
Олігозооспермія |
Низька концентрація сперматозоїдів у спермі |
|
Астенозооспермія |
Знижена рухливість сперматозоїдів, коли значна їх частина демонструє повільний або аномальний рух, що впливає на фертильність |
|
Тератозооспермія |
Аномальна морфологія сперматозоїдів, яка характеризується високим відсотком сперматозоїдів із морфологічними дефектами, що може впливати на фертильність |
|
Нормозооспермія |
Нормальні параметри спермограми, включаючи концентрацію сперматозоїдів, їхню рухливість, морфологію та об’єм, що вказують на оптимальний потенціал фертильності |
|
Ретроградна еякуляція |
Стан, коли сперма ретроградно потрапляє у сечовий міхур, замість того щоб виходити через уретру під час еякуляції, що призводить до зниження фертильності |
|
* Ця таблиця надає стислі визначення основних термінів, що використовуються в спермограмі, і сприяє кращому розумінню для дослідників, лікарів та осіб, які шукають інформацію щодо оцінки чоловічої фертильності. |
|
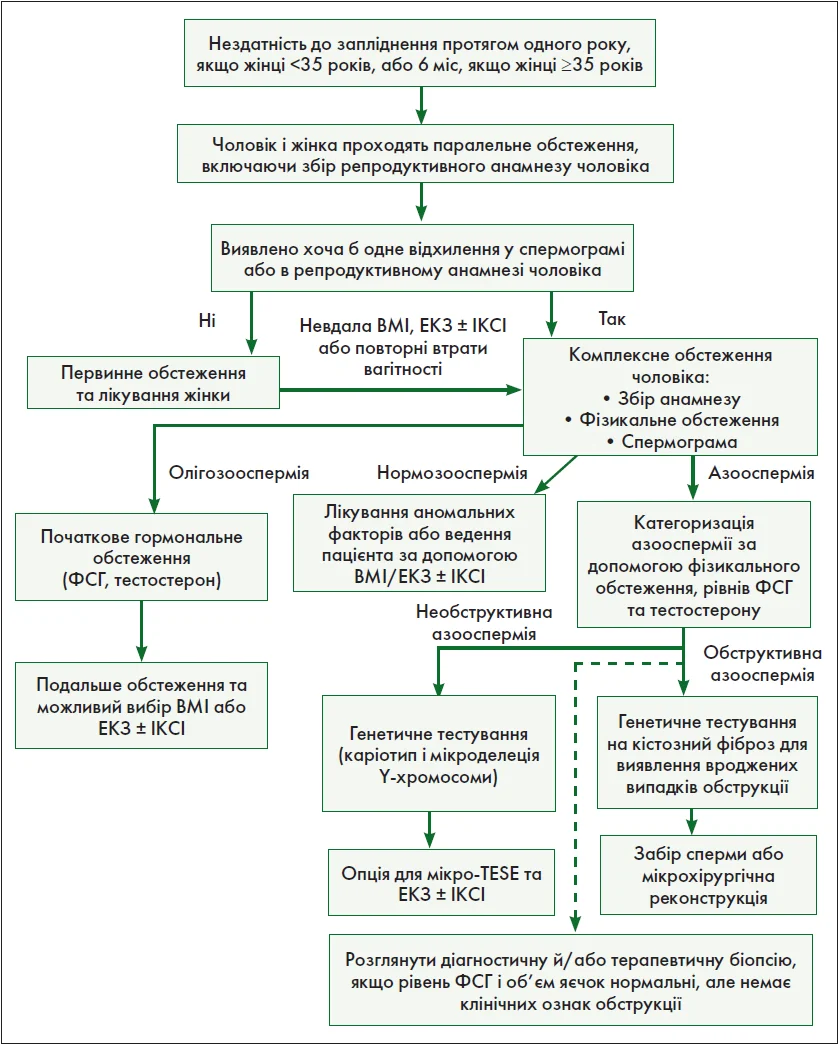 Рис. Алгоритм лікування чоловічого безпліддя
Рис. Алгоритм лікування чоловічого безпліддя
Клінічні рекомендації
Обстеження
Клініцисти повинні включати репродуктивний анамнез до первинного обстеження чоловіка щодо фертильності. (Клінічний принцип)
Також слід призначати одну або більше спермограм під час початкового обстеження чоловіка. (Сильна рекомендація; рівень доказовості B)
Клініцисти повинні повідомляти пацієнтам із безпліддям, що нижні межі параметрів спермограми за стандартами Всесвітньої організації охорони здоров’я (ВООЗ) [3] базуються на п’ятому перцентилі значень для фертильних чоловіків, чиї партнерки завагітніли протягом 12 місяців (табл. 2) [4, 5]. Під час інтерпретації спермограми клініцистам слід пам’ятати, що її параметри є високоваріабельними біологічними показниками і можуть суттєво коливатися між тестами. Тому важливо враховувати результати щонайменше двох таких аналізів, виконаних з інтервалом у місяць, особливо якщо після першого аналізу виявлено аномальні параметри.
|
Таблиця 2. Референтні межі ВООЗ для параметрів чоловічої сперми* |
|
|
Параметр сперми |
Однобічне мінімальне референтне значення (п’ятий перцентиль із 95% довірчими інтервалами) |
|
Об’єм сперми |
1,4 мл (1,3-1,5 мл) |
|
Загальна кількість сперматозоїдів |
39 млн на еякулят (35-40 млн на еякулят) |
|
Концентрація сперматозоїдів |
16 млн/мл (15-18 млн/мл) |
|
Життєздатність |
54% живих (50-56%) |
|
Прогресивна рухливість |
30% (29-31%) |
|
Загальна рухливість (прогресивна + непрогресивна) |
42% (40-43%) |
|
Морфологічно нормальні форми |
4,0% (3,9-4,0%) |
|
* Аналізувалися зразки сперми від 3589 чоловіків (із підтвердженою фертильністю, із невизначеним статусом фертильності та інших, які були нормозооспермічними) із 12 країн і п’яти континентів. |
|
Зростає кількість пацієнтів, які використовують тести для аналізу сперми вдома або надсилають зразки поштою. Хоча такі набори можуть надати певну інформацію про параметри сперми чоловіка, пацієнтам і клініцистам слід розуміти, що численні фактори можуть впливати на точність конкретного тесту. Кожен тест слід оцінювати окремо на точність і надійність, і результати одного типу тестування не можна екстраполювати на інші. На даний час немає альтернативи інформації, яку надає спермограма, виконана у спеціалізованій андрологічній лабораторії, для комплексної оцінки чоловічої фертильності [6]. Експерти з чоловічого репродуктивного здоров’я повинні проводити діагностику зі збором повного анамнезу, фізикальним обстеженням, а також іншими направленими тестами, якщо це показано, за наявності одного та більше аномальних параметрів спермограми або передбачуваного чоловічого безпліддя. (Експертна думка)
Обстеження чоловіка може допомогти деяким парам обрати інші варіанти лікування, окрім ВМІ та ДРТ. Наприклад, дослідники припускають, що лікування варикоцеле може бути більш економічно ефективним, ніж ВМІ та ДРТ, а покращення параметрів спермограми після корекції варикоцеле може знизити інтенсивність лікування, необхідного для партнерки [7, 8]. У парах із невдалими циклами ДРТ або повторними втратами вагітності (дві або більше) лікарі повинні обстежити чоловіка-партнера. (Помірна рекомендація; рівень доказовості C)
У такій клінічній ситуації чоловіків-партнерів повинні обстежувати чоловічі репродуктологи, при цьому клініцисти мають розглянути можливість проведення каріотипування та тестування фрагментації ДНК сперми. Зростає кількість досліджень, які пов’язують погані результати ЕКЗ і повторювані втрати вагітності з аномальним каріотипом чоловіка-партнера [10, 11] та підвищеними рівнями фрагментації ДНК сперми [12].
Фактори способу життя та зв’язок між безпліддям і загальним станом здоров’я
Клініцисти можуть обговорювати фактори ризику (наприклад, спосіб життя, використання медикаментів, вплив навколишнього середовища, професійні шкідливості), пов’язані з чоловічим безпліддям, і доводити до відома пацієнтів, що інформація щодо більшості таких факторів обмежена. (Умовна рекомендація; рівень доказовості C)
Клініцисти повинні обговорювати з пацієнтами стратегії зменшення або запобігання впливу факторів ризику безпліддя. Узагальнення таких факторів наведено в табл. 3 [13-15].
|
Таблиця 3. Узагальнення даних про фактори ризику безпліддя |
|
|
Фактор ризику |
Підсумки методології |
|
Вік |
Чоловіки старшого віку мають незначне зниження фертильності |
|
Ожиріння з/без метаболічного синдрому |
Чоловіки з ожирінням або метаболічним синдромом мають незначно знижену фертильність |
|
Спосіб життя: |
|
|
Дієта |
Погане харчування призводить до зниження фертильності |
|
Кофеїн |
Не є фактором ризику, за винятком анеуплоїдії сперматозоїдів |
|
Алкоголь |
У помірних дозах призводить до незначного зменшення об’єму еякуляту та якості морфології сперматозоїдів, але не впливає на концентрацію сперматозоїдів або їхню рухливість |
|
Куріння |
Курці мають незначно нижчу рухливість сперматозоїдів |
|
Вживання анаболічних стероїдів |
Використання анаболічних стероїдів пов’язане зі зниженою фертильністю |
|
Стрес |
Стрес пов’язаний зі зниженням прогресивної рухливості сперматозоїдів, але не впливає на об’єм сперми; дані щодо концентрації сперматозоїдів і морфології є непереконливими |
|
Мобільні телефони |
Дані непереконливі |
|
Медичні заходи: |
|
|
Антиревматичні препарати |
Дані непереконливі |
|
Тіопурини |
Дані непереконливі |
|
Системні дерматологічні препарати: |
|
|
• фінастерид |
Прийом 5 мг/добу пов’язаний зі зменшенням об’єму сперми, але для 1 мг/добу дані непереконливі |
|
• метотрексат |
Не є фактором ризику |
|
• кортикостероїди |
Дані непереконливі |
|
Операція з приводу пахової грижі: |
|
|
• відкрита без сітки |
Дані непереконливі |
|
• відкрита із сіткою |
Дані непереконливі |
|
• лапароскопічна із сіткою |
Дані непереконливі |
|
Наявність раку яєчка |
Чоловіки з раком яєчка мають знижену фертильність |
|
Фактори довкілля: |
|
|
• бензофенон |
Дані непереконливі |
|
• ді(2‑етилгексил)фталат |
Вплив пов’язаний із нижчою якістю сперми (концентрація сперматозоїдів, рухливість сперми, пошкодження ДНК сперматозоїдів) |
|
• інші хімічні речовини у споживчих продуктах |
Дані непереконливі |
|
Ендокринні негативні чинники |
Дані непереконливі |
|
Пестициди |
Встановлено зв’язок між впливом певних пестицидів (піретроїдів, органофосфатів, абамектину) та гіршими параметрами сперми; для органохлоринів, манкоцебу та інших пестицидів дані непереконливі |
|
Видобуток нафти та газу |
Професійний шкідливий вплив зменшує об’єм сперми та рухливість сперматозоїдів |
|
Забруднення повітря |
Дані непереконливі |
|
Свинець, цинк, мідь |
Рівні свинцю вищі у чоловіків із безпліддям, ніж у фертильних; рівні цинку нижчі у чоловіків із безпліддям; дані щодо рівнів міді в спермі непереконливі |
|
Кадмій |
Рівні кадмію вищі у чоловіків із безпліддям, ніж у фертильних |
Діагностика та обстеження
Клініцисти повинні первинно обстежувати пацієнтів з азооспермією за допомогою фізикального огляду, оцінки об’єму еякуляту, pH сперми та рівня фолікулостимулюючого гормону (ФСГ) для диференціації обструкції органів генітального тракту від порушення сперматогенезу. (Експертна думка)
Азооспермія визначається як відсутність сперматозоїдів в еякуляті. У разі виявлення азооспермії при аналізі лабораторія має центрифугувати еякулят, ресуспендувати осад у невеликій кількості сім’яної плазми й дослідити під мікроскопом у вигляді вологого препарату для виявлення поодиноких сперматозоїдів. Обструктивна азооспермія підозрюється, якщо під час фізикального обстеження діагностуються яєчка нормального розміру, повністю опущені в калитку, двобічно розширені й/або ущільнені епідидиміси з/без відсутності сім’явиносних проток. У таких випадках рівень ФСГ зазвичай становить приблизно <7,6 МО/л [16].
На противагу цьому, коли яєчка атрофовані, особливо при рівні ФСГ >7,6 МО/л, більш імовірною причиною є порушення сперматогенезу (необструктивна азооспермія) [17]. Малий об’єм, кислий pH й азооспермічний еякулят зазвичай свідчать про обструкцію дистального відділу генітального тракту. Це часто зустрічається у пацієнтів із вродженою двобічною відсутністю сім’явиносних проток або обструкцією еякуляторних проток. Дистальна обструкція, яка обмежує або запобігає виділенню секрету сім’яних міхурців, призведе до малого об’єму еякуляту (<1,4 мл) із кислим pH (<7,0). Чоловіки з нормальним pH сперми малоймовірно мають такі форми повної обструкції дистального відділу генітального тракту [18].
Клініцисти повинні рекомендувати проведення каріотипування у чоловіків із первинним безпліддям та азооспермією або концентрацією сперматозоїдів <5 млн/мл у поєднанні з підвищеним рівнем ФСГ, атрофією яєчок або діагнозом порушення сперматогенезу. (Експертна думка)
Аномалії каріотипу є найпоширенішими відомими генетичними причинами чоловічого безпліддя [19]. Вони можуть включати числові хромосомні аномалії, наприклад синдром Клайнфельтера (наявність додаткових Х-хромосом). Найбільш поширеним варіантом є 47, ХХY, але тяжчі випадки демонструють 48, XXXY або 49, XXXXY. Структурні аномалії (делеції, дуплікації, інверсії ділянок аутосомної або статевої хромосоми), такі як робертсонівська транслокація, також можуть призводити до порушення або відсутності сперматогенезу [19-21].
Клініцисти повинні рекомендувати проведення аналізу мікроделецій Y-хромосоми у чоловіків із первинним безпліддям та азооспермією або концентрацією сперматозоїдів ≤1 млн/мл у поєднанні з підвищеним рівнем ФСГ, атрофією яєчок або діагнозом порушення сперматогенезу. (Помірна рекомендація; рівень доказовості B)
Мікроделеції Y-хромосоми виявляються у 8-12% чоловіків із необструктивною азооспермією та у 3-7% – із тяжкою олігоспермією [22]. Вони можуть бути наслідком помилок, які виникають під час гомологічної рекомбінації в мейозі через паліндромну структуру хромосоми. Ділянка фактора азооспермії (AZF) на довгому плечі чоловічої Y-хромосоми складається з трьох зон, що кодують гени, задіяні у сперматогенезі (AZFa, AZFb, AZFc). Сперматозоїди не були отримані за допомогою мікродиссекційної екстракції тестикулярної сперми (мікро-TESE) у чоловіків із повними мікроделеціями AZFa, AZFb, AZFab або AZFabc. Чоловіки з ізольованими мікроделеціями AZFc можуть мати або тяжку олігоспермію, або азооспермію [23]. У чоловіків з мікроделеціями AZFc та азооспермією сперматозоїди можуть бути отримані методом мікро-TESE приблизно в 50% випадків [24].
Якщо сперматозоїди отримані, враховуючи ризик передачі мікроделеції AZFc їхнім синам і, відповідно, їхнього можливого безпліддя, чоловіків слід консультувати щодо цих ризиків та обговорювати можливість проведення передімплантаційної генетичної діагностики у рамках ДРТ. Деякі пари можуть віддати перевагу вибору ембріонів жіночої статі для подальшої імплантації, щоб уникнути народження хлопчиків із вродженим безпліддям [25].
Попередні настанови AUA рекомендували проводити скринінг у чоловіків із концентрацією сперматозоїдів <5 млн/мл. Однак, зважаючи на рідкість мікроделецій Y-хромосоми у чоловіків із концентрацією сперматозоїдів від 1 до 5 млн/мл, наразі експертна група радить проводити скринінг на мікроделеції Y-хромосоми у чоловіків з азооспермією, які мають підозру на порушення утворення сперматозоїдів. Також скринінг слід проводити у чоловіків із тяжкою олігоспермією, коли концентрація сперматозоїдів становить <1 млн/мл.
Візуалізаційні методи обстеження
Лікарі не повинні регулярно виконувати ультразвукове дослідження (УЗД) калитки при початковому обстеженні чоловіків із безпліддям. (Експертна думка) Рутинне проведення ультразвукової діагностики при підозрі на варикоцеле не рекомендоване, оскільки лікування непальпабельних форм не покращує показники спермограми та рівень фертильності. На відміну від цього корекція пальпабельного варикоцеле сприяє покращенню якості сперми та підвищенню фертильності.
УЗД калитки може бути виконано перед хірургічним втручанням для підтвердження наявності варикоцеле, а також після корекції для визначення успішності процедури у контексті спільного з пацієнтом прийняття рішень.
Лікарі не повинні виконувати трансректальне УЗД (ТРУЗД) або МРТ органів малого таза як частину початкового обстеження чоловіка з безпліддям. Лікарі можуть рекомендувати ТРУЗД або МРТ органів малого таза у чоловіків із результатами спермограми, що вказують на можливу обструкцію еякуляторних проток (ОЕП) (тобто кисла, азооспермічна сперма з об’ємом <1,4 мл, нормальний рівень тестостерону, пальповані сім’явиносні протоки). (Експертна думка)
Для діагностики безпліддя обстеження органів малого таза має на меті визначити анатомію основних органів/структур, що беруть участь в еякуляції, включаючи передміхурову залозу, сім’яні міхурці, ампулу сім’явивідної протоки та еякуляторні протоки [27]. ТРУЗД може бути корисним для виявлення обструкції дистального відділу генітального тракту, що призводить до обструктивної азооспермії або тяжкої олігозооспермії з дуже низькою рухливістю сперматозоїдів, як це спостерігається у чоловіків з ОЕП. МРТ органів малого таза зараз широко доступне і може надавати більш точну оцінку дилатації еякуляторних проток та сім’яних міхурців. Крім того, МРТ органів малого таза може виявити та охарактеризувати простатичні кісти, зокрема парамедіанні (тобто кісти еякуляторних проток) і серединні (тобто кісти мюллерової протоки та простатичної утрикули), які можуть спричиняти обструкцію еякуляторної протоки. Лікар повинен підозрювати обструкцію дистального відділу генітального тракту у чоловіків, коли об’єм еякуляту малий (<1,4 мл), а сперма кисла (pH <7,0). Більшість цих чоловіків матимуть відсутність фруктози у спермі, хоча тестування на фруктозу є відносно ненадійним і не є необхідним, особливо у чоловіків із високим рівнем підозри (тобто якщо спермограма показує малий об’єм, кислотність, азооспермію або олігозооспермію з дуже низькою рухливістю сперматозоїдів). У таких чоловіків слід розглянути можливість проведення ТРУЗД або МРТ органів малого таза для оцінки анатомічних аномалій [28]. Інші аспекти еякуляту також слід враховувати. Нормальна сперма складається з рідин, що виділяються яєчками (близько 10%), простатою (близько 20%) і сім’яними міхурцями (близько 70%). Усі ці компоненти чутливі до андрогенів, тому чоловіки з дефіцитом тестостерону можуть мати малий об’єм сперми, і користь обстеження органів малого таза в таких випадках може бути низькою. Крім того, рідина сім’яних міхурців є лужною. Обструкція, що обмежує або запобігає надходженню секрету сім’яних міхурців, призведе до кислого середовища сперми (pH <7,0). У чоловіків із нормальним pH сперми малоймовірна наявність повної обструкції дистального відділу генітального тракту [18].
Вроджені аномалії також можуть впливати на нормальну анатомію генітального тракту. Мутації в гені CFTR можуть призводити до агенезії/атрезії сім’явиносних проток та сім’яних міхурців. У чоловіків із вродженою двобічною відсутністю сім’явивідних проток обстеження малого таза не сприяє діагностиці або лікуванню, тому його не слід проводити у цієї категорії чоловіків із безпліддям [18]. Окрім безпліддя, біль під час еякуляції також може бути причиною для проведення ТРУЗД або МРТ малого таза, оскільки діагностування обструкції може бути показанням до призначення лікування для полегшення симптоматики. У чоловіків із нормальною еякуляцією та об’ємом сперми результати ТРУЗД або МРТ малого таза зазвичай не змінять стратегію лікування від безпліддя. Таким чином, за відсутності симптомів (наприклад, біль під час еякуляції) або змін параметрів спермограми (наприклад, малий об’єм сперми з азооспермією та пальповані сім’явиносні протоки або малий об’єм сперми та значна астеноспермія) обстеження малого таза не має бути включено до діагностики безпліддя.
Забір сперми
У чоловіків із необструктивною азооспермією (НОА), які проходять процедуру забору сперми, клініцисти повинні виконувати мікро-TESE. (Помірна рекомендація; рівень доказовості C)
Мікро-TESE передбачає широке розсічення tunica albuginea (тонка фіброзна оболонка) для візуалізації кількох ділянок тканини яєчка. Вибір ділянок здійснюється за центрифугальним принципом, паралельно до інтратестикулярних кровоносних судин, що забезпечує ретельний огляд майже всієї тканини яєчка при мінімальному ризику її деваскуляризації. Традиційна TESE була пов’язана зі зниженням рівня тестостерону в післяопераційному періоді, і багато чоловіків із НОА мають вихідний дефіцит тестостерону. Після мікро-TESE вплив на рівень тестостерону є менш вираженим, ніж при традиційній TESE, але дефіцит тестостерону, що потребує замісної терапії, становить ризик навіть після мікро-TESE [29].
У метааналізі опублікованих досліджень щодо чоловіків із НОА було виявлено, що мікро-TESE забезпечує успішний забір сперми в 1,5 раза частіше, ніж при немікрохірургічному заборі сперми з яєчка, а традиційна TESE є результативною в 2 рази частіше, ніж тестикулярна аспірація [30].
У чоловіків, які проходять хірургічний забір сперми під наглядом лікаря, ІКСІ може бути виконана як зі свіжою, так і з кріоконсервованою спермою. (Умовна рекомендація; рівень доказовості C)
У чоловіків з обструктивною азооспермією зазвичай вдається отримати достатню кількість сперматозоїдів для кріоконсервації з високою ймовірністю їх виживання для використання у ДРТ. Істотних відмінностей у показниках успішності ЕКЗ немає, тому отримання сперми та її кріоконсервація можуть бути виконані для проведення ДРТ. Вибір між свіжою та кріоконсервованою спермою часто залежить від уподобань ембріологічної лабораторії, яка співпрацює з хірургом.
У чоловіків з азооспермією, зумовленою обструкцією, які проходять хірургічний забір сперми, лікарі можуть отримувати сперматозоїди як із яєчка, так і з придатка яєчка. (Умовна рекомендація; рівень доказовості C)
Хоча наявні дослідження мають низьку якість, показники запліднення, вагітності та живонародження були подібними для сперматозоїдів, отриманих із придатка та яєчка у чоловіків з азооспермією, спричиненою обструкцією [31]. Однак отримання сперматозоїдів із придатка слід уникати, якщо планується майбутня мікрохірургічна реконструкція (тобто вазовазостомія або епідидимовазостомія) через ризик утворення рубцевої тканини та подальшої обструкції [32].
Лікарі можуть розглянути можливість використання сперматозоїдів, узятих із яєчка, у чоловіків без азооспермії з підвищеним індексом фрагментації ДНК (ІФД) сперматозоїдів. (Клінічний принцип)
Використання сперматозоїдів, узятих із яєчка, у чоловіків без азооспермії з підвищеним ІФД є альтернативним варіантом лікування безпліддя [34]. Процедури забору сперматозоїдів із яєчка, такі як аспірація або екстракція, дають змогу отримати життєздатні сперматозоїди з нижчим ІФД, що потенційно підвищує ймовірність успішного застосування ДРТ [35].
Важливо, щоб урологи співпрацювали з репродуктологами-ендокринологами та ембріологами для визначення найбільш доцільної тактики відповідно до індивідуальних особливостей пацієнта та його уподобань. Для пар із підвищеним рівнем фрагментації ДНК сперматозоїдів також рекомендовано обговорити альтернативні варіанти лікування, такі як модифікація способу життя (зокрема, відмова від куріння), усунення варикоцеле та можливе використання мікрофлюїдної технології як методу обробки сперми [36].
Клініцисти можуть лікувати безпліддя, пов’язане з ретроградною еякуляцією, за допомогою симпатоміметиків (зокрема, із підлужуванням сечі й/або катетеризацією уретри), індукованої еякуляції або хірургічного забору сперми. (Експертна думка)
Часткова ретроградна еякуляція може співіснувати з частковою антеградною еякуляцією. Якщо антеградний зразок є достатнім для репродукції природним шляхом або з медичною допомогою, лікування може бути непотрібним [37]. Однак, якщо антеградний еякулят поганої якості, а значну ретроградну еякуляцію підтверджує постеякуляційний аналіз сечі, можуть бути рекомендовані різні методи лікування (наприклад, оральні симпатоміметики з підлужуванням сечі й/або введенням середовища для промивання сперми в сечовий міхур через уретральний катетер перед оргазмом, із подальшим вилученням сперми з міхура після оргазму). Індукована еякуляція та хірургічний забір сперми також є варіантами лікування у цьому випадку.
Обструктивна азооспермія, включаючи безпліддя після вазектомії
У чоловіків із безпліддям з ОЕП лікарі можуть розглянути трансуретральну резекцію еякуляторних проток і/або хірургічний забір сперми. (Експертна думка)
ОЕП рідко зустрічається у чоловіків із безпліддям. Якщо діагноз підтверджений або підозрюється за результатами ТРУЗД чи МРТ органів малого таза, слід розглянути можливість лікування. Результати МРТ органів малого таза, які вказують на обструкцію, включають передньо-задній діаметр сім’яних міхурців >15 мм, діаметр еякуляторних проток (>2,3 мм) або розширення ампули сім’явивідної протоки (>6 мм), а також кісти передміхурової залози (серединна простатична кіста або парамедіанна/еякуляторна кіста). Якщо аспірат сім’яних міхурців виявляє наявність сперматозоїдів у чоловіка з азооспермією, йому може бути запропонована трансуретральна резекція еякуляторних проток [18]. Метою хірургічного втручання є усунути обструкцію еякуляторних проток і, таким чином, дозволити спермі потрапити до еякуляту, який може бути використаний для природного зачаття, ВМІ або ДРТ.
Медичні та нутрацевтичні втручання для фертильності
Чоловіче безпліддя можна лікувати за допомогою ДРТ. (Експертна думка)
Лікування ЕКЗ вимагає більше ніж тижневої стимуляції яєчників, процедури для отримання ооцитів і внутрішньоматкової трансплантації ембріонів; кожен цикл зазвичай дає 37% показник живонародження на один ініційований цикл ЕКЗ [38]. Результати вагітності та живонародження тісно пов’язані з віком жінки, із поступовим зниженням шансів на досягнення позитивного результату (>35 років). Приблизно 12,5% усіх пологів супроводжуються народженням двійні, а додаткові вагітності можуть виникнути від одного циклу ЕКЗ, якщо є додаткові ембріони для кріоконсервування [38].
У випадку гіпогонадотропного гіпогонадизму клініцисти повинні обстежити пацієнта, щоб визначити етіологію розладу та лікувати на основі діагнозу. (Клінічний принцип)
Екзогенна терапія тестостероном часто призначається пацієнтам з ідіопатичним гіпогонадотропним гіпогонадизмом (ІГГ), але це лікування інгібує внутрішньояєчкову продукцію тестостерону та пригнічує сперматогенез, тим самим погіршуючи фертильність [39]. Це поширена проблема серед підлітків з ІГГ, яких часто починають лікувати екзогенним тестостероном для індукції пубертату, але іноді пацієнти залишаються на цій терапії і в дорослому віці, у репродуктивному періоді життя [40].
Зазвичай першим препаратом для лікування ІГГ із метою відновлення продукції тестостерону та сперматогенезу є хоріонічний гонадотропін людини (ХГЛ). Ступінь відповіді корелює з розміром яєчок до початку лікування [41]. Початкова терапія проводиться за допомогою ін’єкцій ХГЛ (500-2500 МО 2-3 рази на тиждень), після чого, якщо це вказано, призначають ін’єкції ФСГ, коли рівень тестостерону нормалізується на фоні застосування ХГЛ. Введення гонадотропін-рилізинг-гормону в пульсуючому режимі на даний момент у США та Європі не схвалено. Якщо медикаментозна терапія у чоловіка з ІГГ не супроводжується заплідненням, але виявлено сперму в еякуляті, рекомендовано направлення на ВМІ або ДРТ.
Чоловікам, які зацікавлені в поточному або майбутньому збереженні фертильності, клініцисти не повинні призначати екзогенну терапію тестостероном. (Клінічний принцип)
Застосування екзогенного тестостерону забезпечує негативний зворотний зв’язок із гіпоталамусом і гіпофізом, що може призводити до пригнічення секреції гонадотропінів. Залежно від ступеня тестостерон-індукованого пригнічення сперматогенез може знижуватися чи припинятися повністю, що спричиняє оліго- або азооспермію [42]. Хоча в більшості чоловіків з азооспермією після припинення терапії тестостероном сперматозоїди з’являються в еякуляті, процес відновлення може бути тривалим (від кількох місяців до, у рідкісних випадках, кількох років) [43]. Тому екзогенна терапія тестостероном має бути виключена у чоловіків, які планують народження дітей найближчим часом. Для тих, хто планує батьківство в більш віддаленій перспективі, терапія тестостероном може бути запропонована, але пацієнта слід поінформувати про її супресивний вплив на сперматогенез і тривалість необхідного періоду для його відновлення після припинення лікування.
Клініцист має пояснити пацієнту, що користь від прийому добавок (наприклад, антиоксидантів або вітамінів) у лікуванні чоловічого безпліддя є сумнівною. Наявні дані є недостатніми для надання рекомендацій щодо конкретних засобів, які слід застосовувати з цією метою. (Помірна рекомендація; рівень доказовості B)
Клініцист може проінформувати пацієнта з НОА про недостатність даних щодо ефективності фармакологічної корекції селективними модуляторами естрогенних рецепторів, інгібіторами ароматази та гонадотропінами перед хірургічним втручанням. (Умовна рекомендація; рівень доказовості C)
У будь-якого пацієнта з НОА ідеальним підходом є оптимізація сперматогенезу, а отже, підвищення ймовірності отримання сперматозоїдів під час хірургічного забору сперми. Селективні модулятори естрогенних рецепторів, інгібітори ароматази та ХГЛ застосовуються поза зареєстрованими показаннями з метою оптимізації рівня чоловічих репродуктивних гормонів, щоб стимулювати виділення сперматозоїдів в еякулят або покращити показники хірургічного забору сперми. Утім лише частина пацієнтів є кандидатами на медикаментозну терапію на основі початкового гормонального обстеження, а дані щодо результатів лікування з використанням цих препаратів до операції обмежені [50].
Гонадотоксична терапія та збереження фертильності
Клініцисти повинні заохочувати чоловіків здавати сперму на зберігання, бажано кілька зразків, якщо це можливо, перед початком гонадотоксичної терапії або іншого лікування раку, яке може вплинути на фертильність у чоловіків. (Експертна думка)
Пацієнту слід запропонувати можливість, якщо це клінічно доцільно, зберегти сперму перед гонадотоксичною терапією. Це може передбачати надання кількох зразків еякуляту в андрологічну лабораторію протягом кількох днів. Кріоконсервація сперми також може бути здійснена за допомогою поштових наборів для збору зразків у ситуаціях, коли доступ до медичної допомоги обмежений. У разі якщо пацієнт не може еякулювати, можна розглянути електроеякуляцію або TESE; для чоловіків, у яких в еякуляті немає життєздатних сперматозоїдів, TESE є прийнятним варіантом [51].
Клініцисти повинні інформувати чоловіків, які бажають зберегти фертильність, що у разі збереження азооспермії після гонадотоксичної терапії мікро-TESE є варіантом лікування. (Сильна рекомендація; рівень доказовості B)
Мікро-TESE стала основним методом у веденні пацієнтів із НОА, якщо остання не спричинена гонадотоксичною терапією. Залежно від ряду факторів рівень успішності забору сперматозоїдів при використанні мікрохірургічної TESE становить 40-60% [52, 53]. Хоча цей метод широко застосовується серед пацієнтів без онкологічних захворювань, досвід його призначення чоловікам, які зазнали впливу гонадотоксичної терапії, значно менший.
Систематичний огляд, проведений для розробки цієї настанови, виявив 7 досліджень, що оцінювали застосування хірургічного забору сперматозоїдів (4 традиційних TESE, 3 мікро-TESE) у чоловіків, які перенесли гонадотоксичну терапію [52-58]. Ці дослідження включали пацієнтів із різними типами онкологічних захворювань. Час, що минув між впливом гонадотоксичної терапії та процедурою забору сперматозоїдів, у середньому складав 11 років (діапазон – 5-19 років). Спроби забору сперматозоїдів зазвичай відкладають принаймні на два роки після хіміотерапії. Автори всіх 7 досліджень повідомили про рівень успішності забору сперматозоїдів, проте лише одне дослідження містило дані про частоту запліднення/живонародження.
Перспективи розвитку
Геномна революція дозволила значно покращити діагностичні можливості для визначення точних етіологічних чинників, супутніх захворювань, а можливо, і розробки медикаментозних методів лікування безпліддя у чоловіків, що сприятиме не лише їхній репродуктивній здатності, а й загальному здоров’ю. Вплив певних способів життя та поведінкових факторів залишається недостатньо вивченим. Наприклад, вейпінг і вживання канабісу широко поширені серед молодих людей, але їхній коротко- та довгостроковий вплив на репродуктивне здоров’я залишається нез’ясованим [59-62]. Ожиріння та метаболічний синдром можуть погіршувати чоловічу фертильність через низку патофізіологічних механізмів, однак здатність відновити репродуктивний потенціал завдяки зниженню ваги та покращенню метаболічного здоров’я вивчена недостатньо. Агоністи рецепторів глюкагоноподібного пептиду 1 демонструють високу ефективність у лікуванні ожиріння та цукрового діабету 2‑го типу, проте їхній вплив на репродуктивне здоров’я поки що не визначений. Реалізація описаних вище наукових досягнень відбуватиметься поступово, однак зрештою вони перейдуть із лабораторних досліджень у клінічну практику, надаючи чоловічій популяції більше терапевтичних можливостей. Майбутнє виглядає багатообіцяючим щодо покращення здоров’я та фертильності у чоловіків із безпліддям завдяки персоналізованій медицині та впровадженню новітніх технологій.
Реферативний огляд підготувала Дарія Чорна
За матеріалами: Brannigan R.E., Hermanson L., Kaczmarek J. et al. Updates to Male Infertility: AUA/ASRM Guideline (2024). J Urol. 2024 Dec;212(6):789-799.
Тематичний номер «Урологія. Нефрологія. Андрологія» № 1 (36), 2025 р.



