16 квітня, 2025
Як українська медична система відповідає на виклик антибіотикорезистентності: чи стануть синергідні тести рішенням проблеми?
Пам’яті захисника України, військового та пацієнта
Інституту нейрохірургії ім. акад. А.П. Ромоданова НАМН України
Геннадія Долголікова («Stern»)
 Згідно зі звітом «Глобальний тягар хвороб» 2019 року, з інфекційними захворюваннями пов’язано 14 млн випадків летальності, що робить дану категорію хвороб другою основною причиною смерті після ішемічної хвороби серця. Бактеріальні інфекції є причиною 7,7 млн смертей, з яких 1,3 млн пов’язані з антибіотикорезистентністю патогенів [1]. Рівень летальності в Україні, яка асоційована з інфекційними захворюваннями, включаючи госпітальні інфекції, залишається остаточно не встановленим через відсутність спеціального органу мікробіологічного моніторингу закладів охорони здоров’я. Із початком повномасштабного вторгнення в західній науковій періодиці обговорюється теза, що причиною високої антибіотикорезистентності в Україні є збройний конфлікт [2]. Темі причин, механізмів розвитку, шляхів подолання антибіотикорезистентності та актуальним питанням антибіотикотерапії (АБТ) в Україні була присвячена розмова зі старшим науковим співробітником групи дослідження біоплівок ДУ «Інститут молекулярної біології і генетики НАН України», кандидатом біологічних наук Оленою Володимирівною Мошинець.
Згідно зі звітом «Глобальний тягар хвороб» 2019 року, з інфекційними захворюваннями пов’язано 14 млн випадків летальності, що робить дану категорію хвороб другою основною причиною смерті після ішемічної хвороби серця. Бактеріальні інфекції є причиною 7,7 млн смертей, з яких 1,3 млн пов’язані з антибіотикорезистентністю патогенів [1]. Рівень летальності в Україні, яка асоційована з інфекційними захворюваннями, включаючи госпітальні інфекції, залишається остаточно не встановленим через відсутність спеціального органу мікробіологічного моніторингу закладів охорони здоров’я. Із початком повномасштабного вторгнення в західній науковій періодиці обговорюється теза, що причиною високої антибіотикорезистентності в Україні є збройний конфлікт [2]. Темі причин, механізмів розвитку, шляхів подолання антибіотикорезистентності та актуальним питанням антибіотикотерапії (АБТ) в Україні була присвячена розмова зі старшим науковим співробітником групи дослідження біоплівок ДУ «Інститут молекулярної біології і генетики НАН України», кандидатом біологічних наук Оленою Володимирівною Мошинець.
Ключові слова: антибіотики, антибіотикотерапія, антибіотикорезистентність, синергідні тести.
? Які ключові причини антибіотикорезистентності у всьому світі й, зокрема, в Україні? Наскільки дана проблема пов’язана з повномасштабним вторгненням?
– Теза про те, що збройний конфлікт є причиною антибіотикорезистентності в Україні, не є правильною. Вона сформувалася внаслідок певного замовчування даної проблеми, некоректності даних, що не відображають дійсний стан справ, і відсутності координації між національними та європейськими закладами щодо моніторингу поширення стійких штамів бактерій. Певну роль у висвітленні проблеми антибіотикорезистентності відіграла залученість європейських госпіталів до лікування українських військових [3-5].
Насправді, проблема антибіотикорезистентності та появи госпітальних полірезистентних ізолятів, тобто штамів, які стійкі до всіх антибіотиків, доступних на фармринку країни, з’явилася не внаслідок військового конфлікту, а існувала задовго до нього. Спираючись на аналітичні дані, можна припустити, що загальними причинами високої антибіотикорезистентності є недостатнє, нераціональне фінансування медичної галузі та невисокий середній рівень доходів населення [6]. За даними Collignon et al. (2018), однофакторний аналіз таких показників, як ВВП на душу населення, рівень освіти, розвиток інфраструктури, державні витрати на охорону здоров’я та споживання антибіотиків, показав обернену кореляцію з індексами резистентності до антимікробних препаратів. Натомість висока температура (негативний екологічний фактор), неефективне державне управління, порушення співвідношення державних і приватних витрат на охорону здоров’я позитивно корелюють із ростом антибіотикорезистентності в країні.
У багатофакторному регресійному аналізі за участю 73 країн, для яких були доступні дані щодо застосування антибіотиків, оцінювали зміни індексів резистентності Escherichia coli (R= 0,54) і сукупної резистентності (R=0,75) залежно від рівня розвитку інфраструктури (p=0,014, p=0,0052) і ретельнішого контролю за призначенням АБТ (p=0,025, p<0,0001). Як результат, останні показники асоціювалися з нижчими індексами антимікробної резистентності. Натомість призначення антибіотиків не було суттєво пов’язане з індексом антимікробної резистентності [7]. Таким чином, залучення держави до вирішення проблеми резистентності, збільшення фінансування й доступності державної медицини, покращення інфраструктури, а не обмеження застосування найдоступніших антибіотиків, є ефективною стратегією протидії антибіотикорезистентності.
? Як відбуваються моніторинг та дослідження антибіотикорезистентності в Україні на даний час?
– Залученість держави щодо протидії поширеності антибіотикорезистентності в Україні наразі є недостатньою. Незважаючи на різноманітні структури в галузі охорони здоров’я, жодного сучасного центру дослідження проблеми антибіотикорезистентності в Україні не створено. Активних дій із запровадження експертного осередку, тобто підготовки власних кадрів, обізнаних у проблемі антибіотикорезистентності в Україні, також не спостерігається. На сьогодні існує Центр громадського здоров’я Міністерства охорони здоров’я України (далі – ЦГЗ. – Ред.), який мав би перебрати на себе моніторингові функції мікробіологічного контролю. Утім на даний момент дослідження щодо динаміки, механізмів антибіотикорезистентності в країні та клінічні дослідження з вивчення ефективності АБТ державними органами не проводяться.
Така незадовільна ситуація з організацією мікробіологічного контролю не могла не знайти відображення в міжнародних публікаціях. Так, у масштабному аналізі ефективності національних урядів 114 країн щодо протидії розвитку антибіотикорезистентності за 2021-2022 роки, який було оприлюднено у 2023 році, Україна посіла передостаннє місце, розділивши його зі Сьєрра-Леоне. Гіршими за показниками мікробіологічного контролю були тільки Барбадос і Мікронезія, хоча з висновками дослідження не все однозначно. Серед чотирьох аутсайдерів рейтингу урядової ефективності тільки Україна мала безпрецедентно низькі (нульові) бали в категорії «Моніторинг і оцінка» («Monitoring and evaluation»), що складалися з чотирьох підпунктів, кожен з яких оцінювався окремо, а саме: «Звітування» («Reporting»), «Зворотна відповідь» («Feedback mechanism»), «Ефективність» («Effectivenes») і «Дослідження антимікробної резистентності» («Antimicrobial resistance research»). Цікаво, що зі 114 країн не знайшлося більше жодної, яка б отримала чотири оцінки «0» для кожного з підпунктів оцінювання ефективності моніторингу. Тобто в плані моніторингових і наукових досліджень антибіотикорезистентності за ініціативи МОЗ України наша країна є абсолютним аутсайдером. Лише дві категорії активності щодо питання резистентності принесли Україні бали при визначенні рейтингу: підпункт «Участь» («Participation») у розділі «Дизайн політики» («Policy design») (72 бали зі 100 можливих) і підпункт «Профілактика та контроль інфекцій» («Infection prevention and control») у розділі «Інструменти реалізації» («Implementation tools») (77 балів) [8].
Важко не погодитися з авторами вищезгаданого аналізу, оскільки, на мою думку, в Україні відсутній експертний осередок з питання антибіотикорезистентності, що призводить до ігнорування необхідності окремих дослідницьких прикладних програм, недооцінки важливості даної проблеми і відсутності формування стратегії ефективної протидії резистентності в умовах України, тобто саме з урахуванням української специфіки. Більше того, складається враження неврахування світового досвіду, недостатнього розуміння проблеми та корекції світових стандартів за відсутності розуміння першопричини, концентрації уваги на тих факторах, що на поверхні, й оминання справжньої сутності мікробіологічного контролю з боку спеціалістів ЦГЗ. Наприклад, 17 січня 2025 року Кабінет Міністрів України ухвалив Розпорядження № 38-р «Про затвердження переліку науково-технічних (експериментальних) розробок у рамках виконання державного замовлення на найважливіші науково-технічні (експериментальні) розробки та науково-технічну продукцію у 2025-2026 роках», де в медичній сфері планується «розвиток сучасних медичних технологій – нових методів лікування й діагностики онкологічних захворювань, розвиток первинної, спеціалізованої, реабілітаційної медицини з використанням штучного інтелекту (3 розробки)». Тобто знову жодної уваги до питань з антибіотикорезистентності та методів її подолання.
? Як впроваджується в Україні світова практика боротьби з антибіотикорезистентністю?
– Міжнародна класифікація антибіотиків «Access, Watch, Reserve – AWaRe» була розроблена Всесвітньою організацією охорони здоров’я саме для того, щоб систематизувати розуміння залежності ризиків розвитку антибіотикорезистентності від інтенсивності використання антибактеріальних препаратів. Цей підхід базується на розумінні механізмів резистентності, перехресної дії (коли один антибіотик може стимулювати множинні механізми стійкості) та загальної ефективності/широти спектра активності препарату. Використання цього документа є рекомендованим для всіх країн, водночас український уряд розробив власні стратегії. Основним документом, який регулює проведення АБТ в Україні, є Стандарт медичної допомоги «Раціональне застосування антибактеріальних і антифунгальних препаратів з лікувальною та профілактичною метою» (далі – Стандарт. – Ред.) [9].
Згідно зі Стандартом, цефтріаксон і левофлоксацин переведені з категорії «Watch» (препарати вибору/альтернативні) до категорії «Reserve» (група резерву), хоча інші цефалоспорини третього покоління і фторхінолони залишились у категорії «Watch». У якості аргументів щодо внесення змін до Стандарту автори приводять твердження «про розповсюджене надлишкове використання цефтріаксону та левофлоксацину і значне поширення резистентності до цих антибіотиків». Натомість вибіркова чутливість саме до цих препаратів не підтверджена, оскільки індукція цефалоспоринази ampC відбувається пеніцилінами і цефалоспоринами першого покоління (а не третього!), тому фенотип резистентності до цефтріаксону в Україні у грамнегативних збудників пов’язаний із суперекспресією ефлюксів, які індукуються, у тому числі, фторхінолонами. Тобто заборона використання цефтріаксону та левофлоксацину не призведе до відновлення чутливості до цих антибіотиків, оскільки резистентність до них є перехресною і часто реалізується комплексними механізмами [10].
Загалом, щодо обмеження застосування даних антибіотиків постає багато запитань. Чому лікарні несуть відповідальність щодо закупівель найдешевших антибіотиків, але з широким спектром із категорії «Watch»? Чи наявна доказова база, що саме ці антибіотики є причиною епідемії антибіотикорезистентності? Який відсоток використання цих двох антибіотиків у державних лікарнях, оскільки відомо, що значна кількість антибактеріальних препаратів під час стаціонарного лікування купується за кошти пацієнтів? Чи не призведуть нововведення до Стандарту, які фактично забороняють використання цефтріаксону й левофлоксацину, до більш інтенсивного використання карбапенемів, адже вони залишились у групі «Watch»? Чи було враховано, що карбапенеми, попри належність до групи «Watch», є антибіотиками, призначення яких має бути мінімізовано для збереження їхньої ефективності в майбутньому [11]? Чи єможливість оцінити, як заборона цефтріаксону і левофлоксацину вплине на динаміку антибіотикорезистентності? Я впевнена, що ні, механізми зворотного зв’язку відсутні. Утім вже є дані, які підтверджують зростання закупівель меропенему в Україні [12].
? Чи існує загроза епідемії антибіотикорезистентності в Україні?
– Незважаючи на численні публікації закордонних експертів щодо важкої cитуації з поширенням антибіотикорезистентності в Україні [13] та про численні факти надзвичайної стійкості госпітальних ізолятів в українських пацієнтів, яких було прийнято на лікування у ЄС [14], в Україні офіційно епідемії антибіотикорезистентності не оголошено. Немає жодних програм із моніторингу, відсутні центри вивчення проблеми та державні програми стимулювання досліджень і пошуку наукових рішень боротьби з резистентністю збудників. Існує єдиний відділ антимікробної резистентності та інфекційного контролю ЦГЗ, який віддає перевагу економічним питанням, зокрема вищезгаданому моніторингу закупівель цефтріаксону або «фінансово-економічному обґрунтуванню впровадження програми адміністрування антимікробних препаратів у закладах охорони здоров’я» [15]. Може скластися враження, що проблеми не існує, а стан мікробіологічного контролю відповідає дійсному положенню країни. І це певною мірою так і є, адже це для світу ми стали епіцентром антибіотикорезистентності. Утім в Україні пацієнти потерпають від інфекцій, що не піддаються АБТ, вже досить давно. Складається враження щодо певної показовості боротьби з епідемією тотальної резистентності, яку хоч і не оголосили в країні, однак усе ж таки доводиться мати її на увазі як існуючу загрозу.
? Які питання, на вашу думку, як спеціаліста з вивчення мікробних біоплівок, потребують більш досконалого вивчення перед упровадженням у вітчизняну клінічну практику?
– Наведу один приклад. Згідно з п. 24 Стандарту, із метою лікування пацієнта з інфекційною хворобою поза сечовими шляхами й за обґрунтованої підозри або підтвердженої наявності грамнегативних МАМР-продуцентів (МАМР – патогени із множинною резистентністю до антимікробних препаратів. – Ред.) метало-β-лактамаз (включно з NDM, VIM і IMP) необхідно призначати цефтазидим/авібактам у комбінації з азтреонамом. Проте жодних досліджень ефективності цієї комбінації в когорті українських пацієнтів не проведено. Дійсно, є дані наукових досліджень за участю американських і європейських пацієнтів, у яких комбінація цефтазидиму/авібактаму з азтреонамом була ефективною у випадку карбапенем-резистентних грамнегативних інфекцій, утім при застосуванні даної комбінації необхідно враховувати механізми резистентності [16]. Як зазначалося раніше, оскільки моніторинг механізмів антибіотикорезистентності ЦГЗ не проводить, то немає даних, які саме β-лактамази, які мобільні елементи, які інфекційні лінії присутні й який відсоток гіпервірулентності клебсієл фіксується в країні.
У 2022 році на базі ДУ «Інститут молекулярної біології і генетики НАН України» (м. Київ) було проведене вибіркове дослідження деяких карбапенемаз у групі 59 полірезистентних і 6 нерезистентних клебсієл. Встановлено, що метало-β-лактамаза NDM є домінуючою в обох групах клебсієл, а її розповсюдженість сягає майже 100%. Це безпосередньо впливає на ефективність комбінації цефтазидиму/авібактаму з азтреонамом [17]. За даними R.A. Sree et al. (2024), ефективність комбінації цефтазидиму/авібактаму з азтреонамом складала 46% у лікуванні інфекцій, викликаних карбапенем-резистентними штамами Pseudomonas aeruginosa, з показником носійства NDM 48% [18]. Тому питання дослідження синергідних комбінацій саме на вітчизняному рівні є надзвичайно важливим, адже молекулярна епідеміологія збудників госпітальних інфекцій є дуже специфічною для різних країн і, як виявилося, карбапенемази українських штамів ближчі до сингапурських, ніж до, наприклад, іспанських (Hernбndez-Garcнa M. et al., 2024) або німецьких (Sandfort M. et al., 2022).
? Яке значення для подолання антибіотикорезистентності мають синергідні терапевтичні комбінації?
– Простих терапевтичних рішень для проблеми антибіотикорезистентності не існує, і синергідні тести теж не є таким рішенням. Є повідомлення про клінічну неефективність комбінацій, відібраних за допомогою таких синергідних тестів. Зокрема, було доведено клінічну неефективність колістину з меропенемом та колістину з доріпенемом попри in vitro синергію (Nutman A. et al., 2020; Bremmer D.N. et al., 2016). У той час як світ інвестує в розробку нових антибіотиків [19-22], наприклад сулопенему, цефідероколу, комбінацій азтреонаму/авібактаму і цефтолозану/тазобактаму, та в тестування нових лікарських форм, вітчизняна система могла б лобіювати доступність нових антибіотиків на національному ринку за доступними для Національної служби здоров’я України (НСЗУ) цінами. Натомість був обраний шлях впровадження синергідних терапевтичних комбінацій, які не відповідають засадам доказової медицини. Вже з 2025 року НСЗУ вимагатиме від лікарень наявності контрактів із лабораторіями, які проводять так званий синергідний тест [23].
Слід зазначити, що жодних стандартів щодо впровадження синергідних тестів у світі не існує, як і не існує діагностичного підходу до їх трактування – у тому розумінні, у якому це намагаються розвинути керівні органи. У 2024 році H. Harris et al. представили перший валідований протокол для синергідного тесту комбінації цефтазидиму/авібактаму з азтреонамом для Enterobacterales, P. aeruginosa, Stenotrophomonas maltophilia і Myroides spp. [24]. Слід зауважити, що цей тест проводиться виключно на рідких середовищах, куди елюються антибіотики з дисків і вноситься інокулят культури відповідно до протоколу. Якщо тест демонструє пригнічення культури, то режим рекомендованої терапії становить 2000/500 мг цефтазидиму/авібактаму в/в кожні 8 годин інфузією протягом 3 годин і 2000 мг азтреонаму в/в кожні 6 годин інфузією протягом 3 годин.
Чому цей протокол для оцінювання взаємодії двох антибіотиків було розроблено на рідких середовищах, а не на агарі? Саме тому, що фізіологічно біоплівки, які неодмінно утворюються за інфекційного процесу, є більш наближеною моделлю бактеріального росту, який розвивається в пацієнта, на чому ми неодноразово наголошували [25]. Саме рідкі культури та обладнання типу Vitek рекомендоване для визначення чутливості до антибіотиків із складною дифузійною динамікою [26].
У вітчизняному дослідженні синергії азитроміцину та колістину щодо групи госпітальних ізолятів Klebsiella pneumoniae ми використовували дві моделі – агар із додаванням азитроміцину + диски з поліміксином і рідке середовище з азитроміцином і колістином. У результаті не було встановлено жодної кореляції між зонами затримки росту на фоні двох антибіотиків і пригніченням біомаси відповідних біоплівок [27] (рисунок).
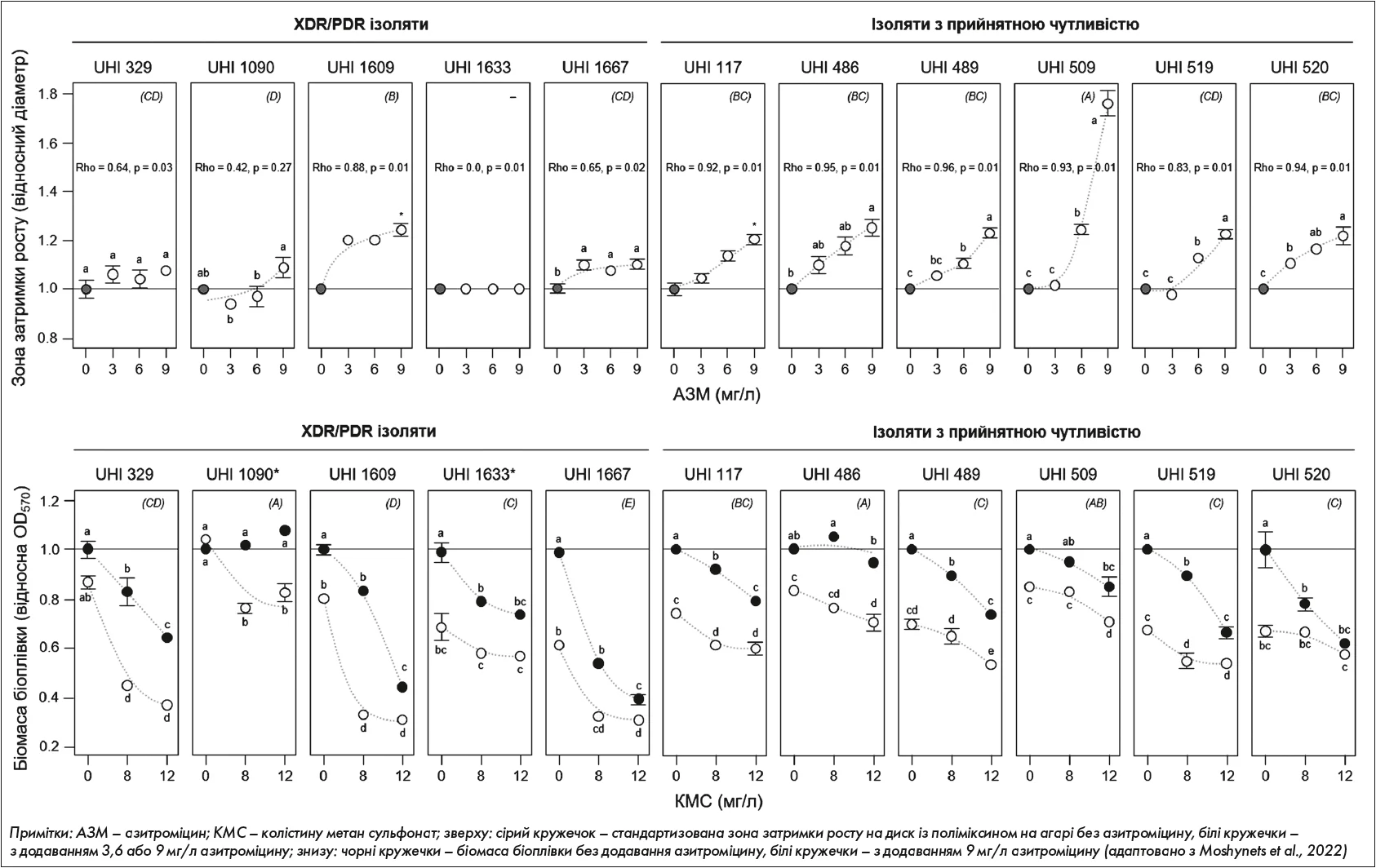 Рис. Порівняльний аналіз взаємодії антибіотиків азитроміцину і колістину у класичному диск-дифузійному тесті за Кірбі – Бауером (верхній ряд) і в біоплівці (нижній ряд) у колекції госпітальних ізолятів K. pneumoniae, отриманих від українських пацієнтів, із розширеною резистентністю (XDR), або повною резистентністю (PDR), або полічутливих
Рис. Порівняльний аналіз взаємодії антибіотиків азитроміцину і колістину у класичному диск-дифузійному тесті за Кірбі – Бауером (верхній ряд) і в біоплівці (нижній ряд) у колекції госпітальних ізолятів K. pneumoniae, отриманих від українських пацієнтів, із розширеною резистентністю (XDR), або повною резистентністю (PDR), або полічутливих
Тобто агаризований диск-дифузійний тест і тест у рідкій культурі давали різні результати і, відповідно, не давали змоги однозначної інтерпретації наявності синергічної дії. Аналогічна тенденція відзначалася й у наступних роботах, коли ми знову не спостерігали кореляції між результатами взаємодії азитроміцину та колістину в біоплівках та розробленій нами рановій моделі in vitro [28]. Феномен розбіжностей ефектів комбінації антибіотиків, що тестуються на агаризованих культурах і біоплівках в умовах in vitro та in vivo, можна пояснити відмінностями у фізіологічних станах бактерій, як це було продемонстровано в порівняльному аналізі мета-транскриптомів (рівні експресії всіх генів у геномах) P. aeruginosa, отриманих у вигляді колоній та в мокротинні, хронічних ранах, опікових інфекціях та в експериментальних тваринних моделях [29]. Зокрема, методом головних компонентів було встановлено високу різницю в транскриптомах агрегацій P. aeruginosa в умовах in vitro та in vivo, що вказує на абсолютну необхідність стандартизації інтерпретації результатів, яка б дала можливість екстраполяції отриманих результатів дослідження зон затримки росту в агаризованих моделях із метою їх ефективного терапевтичного застосування.
? Які особливості тестів на виявлення синергії мають бути враховані?
– Вибір антимікробної терапії, який враховує фармакокінетичну/фармакодинамічну модель для кожного антибіотика, є основним принципом раціональної таргетної антимікробної терапії, зокрема й щодо полірезистентних інфекцій. Саме тому складні in house емпіричні тести на виявлення синергії антимікробних препаратів мають бути максимально наближеними до умов, що моделюють умови in vivo, як у контексті мікробних агрегацій (це мають бути біоплівки, а не агаризовані колонії), так і в контексті концентрацій антибіотиків, вибраних для тестування можливої синергії між ними. Окрім відсутності можливості моделювання актуальної фармакодинаміки, диск-дифузійні (агаризовані) тести відомі своєю низькою чутливістю, що призводить до їх обмеженого використання навіть за умов стандартизованих рекомендацій, які щорічно оприлюднюються Європейським комітетом з тестування чутливості до антимікробних препаратів (EUCAST) [30].
Результати інтерпретації синергічної дії антибактеріальних препаратів залежать не тільки від стандартизації процедури, а й від якості матеріалів. З варіабельністю результатів на фоні різних виробників дисків зіткнулись і розробники першого валідованого CLSI (Clinical and Laboratory Standards Institute) синергідного тесту [31]. Протягом мультицентрового оцінювання протоколу проведення синергідного тесту з’ясувалось, що диски з цефтазидимом/авібактамом одного із двох протестованих виробників (Hardy Diagnostic, USA) не відповідають необхідним стандартам за умови використання середовища Мюлера – Хінтона іншого виробника (Becton, Dickinson, USA), що призводить до хибних результатів тестування. Водночас диски з азтреонамом в обох виробників давали очікуваний (коректний) результат при використанні тестової культури і середовищ Мюлера – Хінтона різних виробників. Таким чином, для проведення синергідного тесту важлива не тільки стандартизація, а й контроль якості матеріалів. Синергія між цефтазидимом/авібактамом і азтреонамом має обмежену поширеність у когорті пацієнтів, тому виникає необхідність у пошуку нових взаємодій між препаратами.
? Як широко можуть бути використані синергідні тести в умовах стандартизації?
– Розуміння важливості врахування фармакодинаміки антибіотиків і природного типу агрегації бактерій орієнтує клініцистів на розробку домашніх (in house), тобто власного виробництва, синергідних тестів на системах із рідкими поживними середовищами і в досяжних фізіологічних концентраціях препаратів. Зокрема, J.W.P. Teo із сінгапурської загальної лікарні оприлюднила результати дослідження синергідного тесту iACT (in vitro Antibiotic Combination Test. – Ред.) протягом 2017-2021 років [32]. Дослідник наголосила, що в синергідному тесті використовуються саме фізіологічні концентрації антибіотиків, які відповідають вільній сироватковій концентрації, що є критично важливим у процесі оптимізації комбінованої АБТ високорезистентних грамнегативних бактерій [33].
На основі досвіду сінгапурської лікарні в iACT-тесті використовуються 180 унікальних комбінацій антибіотиків після стаціонарного інкубування в планшетах протягом доби. Матеріал із лунок, які не показали росту бактерій, висівається, і підраховується кількість колонієутворюючих одиниць (КУО) у лунках із «перспективними» комбінаціями антибіотиків. Якщо в «перспективній» лунці КУО знизилася порівняно з первинною культурою у 3 рази і більше, така комбінація вважається синергідною. За результатами iACT-тесту, найбільш синергідними комбінаціями для карбапенем-резистентних штамів P. aeruginosa було визнано комбінації з поліміксином (не колістином!) – до 90% усіх штамів виявились чутливими до цієї комбінації, а також фосфоміцину з азтреонамом або цефепімом – 69 і 64% штамів проявили чутливість відповідно. Дане когортне дослідження підтвердило терапевтичну ефективність такого методу пошуку синергій для полірезистентних штамів. Була продемонстрована нульова 7-денна і низька (2%) 30-денна смертність; на 7-й день комбінованої синергідної терапії фіксувався позитивний клінічний відгук у 92% пацієнтів і в 90% хворих – наприкінці терапії. Ерадикація інфекції (бактеріємія) спостерігалась у 100% випадків, а найбільш частим побічним ефектом була нейротоксичність (10% пацієнтів).
Аналогічний підхід було використано в іншій роботі, де досліджувалась можливість пошуку синергідної взаємодії колістину, меропенему і даптоміцину для лікування поліміксин-карбапенем-стійких інфекцій, спричинених Klebsiella pneumoniae [34]. Для встановлення можливої синергії використовувалися плашки з рідким середовищем, куди вносили 106 КУО/мл та інкубували з періодичним висіванням на агаризоване середовище для підрахунку КУО. Після 24-годинної інкубації синергію в цьому випадку ідентифікували при більш ніж двократному зниженні порядку КУО. Важливим є те, що, як і раніше, у тесті використовувались фізіологічні концентрації: зокрема, для колістину це було 16 мг/л (0,5ЧМІК [мінімальна інгібуюча концентрація] для обох штамів), 49 мг/л меропенему, що відповідає максимальній концентрації (Сmах) меропенему при введенні 1 г та 9,39 мг/л даптоміцину, що є Сmах даптоміцину при дозуванні 6 мг/кг.
Такий підхід пошуку неканонічних терапевтичних рішень демонструє, що застосування будь-яких потенційно синергідних комбінацій має бути здійснене у фізіологічних концентраціях антибіотиків і перевірене на відповідній когорті пацієнтів. Через високу різноманітність та комбінативність генетичних механізмів, що відповідають одним і тим самим фенотипам резистентності [35], з метою доведення ефективності комбінацій такі дослідження мають бути проведені у національних когортах пацієнтів.
? Щодо проблеми стандартизації проведення синергідних тестів – чому не все так просто, як вважалося?
– Вітчизняний регулятор ЦГЗ пропонує власні версії зразків стандартних операційних процедур (СОП) з організації та проведення бактеріологічних досліджень при здійсненні епідеміологічного нагляду за протимікробною резистентністю. Відповідно до «Порядку здійснення дозорного епідеміологічного нагляду за протимікробною резистентністю» (наказ МОЗ України № 1766 від 19.08.2021 р.), серед вимог до лабораторій, що виконують дослідження для потреб дозорного епідеміологічного нагляду за антимікробною резистентністю інвазивних патогенів, зокрема, йдеться про використання в поточній роботі СОП, які базуються на актуальних версіях методології EUCAST (визначення чутливості бактерій до антибіотиків, інтерпретації значень чутливості, визначення механізмів резистентності, поточного та розширеного контролю якості). Тож на яких стандартах міжнародні експерти в галузі антимікробної резистентності створюють свої рекомендації методології синергідних тестів?
У відповідному документі, розробленому спеціалістами ЦГЗ і Представництвом ВООЗ в Україні, на сторінці 143 надається інструкція щодо методології синергідного тесту «методом подвійних дисків» або «градієнтним методом (на основі MIC Test Strip)» та окремо підкреслюється, що «дотримання положень і вимог цієї СОП є обов’язковим для виконання співробітниками лабораторії, на яких покладаються обов’язки визначення чутливості мікроорганізмів до антибіотиків» (хоча в наказі МОЗ України № 1766 від 19.08.2021 р. відсутні вимоги до ЦГЗ щодо розробки рекомендацій СОП для медичних закладів).
Ми проаналізували нормативні посилання, на яких базується застосування даних синергідних тестів. У документі декларується, що ця СОП розроблена з урахуванням вимог та рекомендацій ДСТУ EN ISO 15189:2015, ДСП 9.9.5-080-02 і двох документів EUCAST: «Breakpoint tables for interpretation of MICs and zone diameters» і «Terminology relating to methods for the determination of susceptibility of bacteria to antimicrobial agents» [36, 37]. У згаданих документах синергія антибактеріальних препаратів не обговорюється. Також були включені дві наукові статті низької категорії науковості, опубліковані в нефаховому журналі Investigative Ophthalmology and Visual Science, який за індикатором SCImago Journal & Country Rank навіть не має компетенції з мікробіології як тематики, та в Indian Journal of Medical Microbiology, який хоч і спеціалізується на мікробіології, утім відноситься до 3 квартилю за критеріями SCImago. У цих двох статтях йдеться виключно про градієнтний метод синергії, який в Україні не буде використовуватися через його надмірну собівартість для пакетів медичних послуг НСЗУ. Єдине посилання, де згадується й обговорюється метод на основі подвійних дисків, стосується публікації 2005 року [38]. Той факт, що метод описано майже 20 років тому, а він досі не рекомендований EUCAST, як того вимагає наказ МОЗ України № 1766 від 19.08.2021 р., робить ці рекомендації невалідними, а в терапевтичній практиці – недоказовими.
Таким чином, попри тривалий час обговорення різноманітних методів дослідження синергії in vitro, усе ще немає валідованих і стандартизованих методів оцінки синергії між антибіотиками, за винятком МІК-тесту дискового елюювання в бульйон на основі азтреонаму та цефтазидиму/авібактаму [31]. Тому такі методи не є рекомендованими світовими організаціями, а рішення про використання тієї чи іншої методики синергідного тесту у власній інтерпретації має ґрунтуватися на твердих і раціональних принципах доказовості, тобто передбачає проведення власних когортних досліджень та оцінки ефективності тієї чи іншої модифікації синергідного тесту.
За відсутності відповідних досліджень, аналізів, науково-методичної роботи, організованої національними регуляторами в медичній сфері, встановлення вимоги про визначення синергії антибактеріальних препаратів для полірезистентних штамів мікроорганізмів за незрозумілою та невалідованою методикою, без клінічної доказової бази ефективності будь-якого синергідного тесту, випробуваного на національній когорті пацієнтів, постає питання щодо існування можливого конфлікту інтересів та нецільових витрат коштів без будь-якої користі для пацієнтів.
Можна навіть говорити про певну шкоду даних методів, оскільки такими комбінаціями стимулюється подальша селекція полірезистентних штамів [39]. Це сприяє ще більшому поширенню таких патогенів, адже неефективна терапія стимулює генетичну і фенотипову резистентність [40] та підтримує пул мобільних генів антибіотикорезистентності в лікувальному закладі. Як результат, втрачається дорогоцінний час пацієнта, скорочується терапевтичне вікно можливостей, що невідворотно призводить до фатальних наслідків для хворого [41-43].
Тож МОЗ України та НСЗУ мають визначитися, яку стратегію в боротьбі з антибіотикорезистентністю обрати. Чи це буде поглиблення проблеми – ще більше необґрунтованих заборон економічно доступних антибіотиків та впровадження недоказових «інноваційних» методів пошуку терапевтичних рішень,чи, нарешті, пряма залученість до роботи із ключовими учасниками фармацевтичного ринку для розширення спектра нових для України, але відомих у світі антибіотиків за доступними цінами? Важливим є створення власного дослідно-експертного середовища, розробка програми моніторингу антибіотикорезистентності, проведення молекулярно-епідеміологічних досліджень і пошук сучасних терапевтичних рішень для полірезистентних інфекцій, але з використанням українських госпітальних ізолятів і саме в когорті вітчизняних пацієнтів.
Отже, для застосування синергідних тестів на базі диск-дифузійного тесту відсутня доказова база, а відтак, цей підхід не є методом раціональної антибактеріальної терапії. Його використання у рутинній практиці погіршує епідеміологічний стан у закладі й сприяє підтримці пулу механізмів антибіотикорезистентності, адже неодмінно призводить до субоптимальної терапії. Складність подолання проблеми антибіотикорезистентності базується не на впровадженні одного лабораторного дослідження, а на комплексному вирішенні питання з переглядом фінансування медичної галузі, проведенням відповідних клінічних досліджень і створенням спеціалізованих органів мікробіологічного контролю з чіткими завданнями щодо моніторингу й аналізу антибіотикорезистентності.
Література
- Brьssow H. The antibiotic resistance crisis and the development of new antibiotics. Microb Biotechnol. 2024 Jul;17(7): e14510.
- Melwani M. How war is spreading drug resistant superbugs across Ukraine and beyond. BMJ. 2022 Nov 22;379: o2731.
- Petrosillo N., Petersen E., Antoniak S. Ukraine war and antimicrobial resistance. Lancet Infect Dis. 2023 Jun;23(6):653-654. doi: 10.1016/S1473-3099(23)00264-5.
- Sandfort M., Hans J.B., Fischer M.A., Reichert F., Cremanns M., Eisfeld J., Pfeifer Y., Heck A., Eckmanns T., Werner G., Gatermann S., Haller S., Pfennigwerth N. Increase in NDM‑1 and NDM‑1/OXA‑48-producing Klebsiella pneumoniae in Germany associated with the war in Ukraine, 2022. Euro Surveill. 2022 Dec;27(50):2200926.
- Berger F.K., Schmartz G.P., Fritz T., Veith N., Alhussein F., Roth S., Schneitler S., Gilcher T., Gдrtner B.C., Pirpilashvili V., Pohlemann T., Keller A., Rehner J., Becker S.L. Occurrence, resistance patterns, and management of carbapenemase-producing bacteria in war-wounded refugees from Ukraine. Int J Infect Dis. 2023 Jul;132:89-92.
- Savoldi A., Carrara E., Gladstone B.P., Azzini A.M., Gцpel S., Tacconelli E. Gross national income and antibiotic resistance in invasive isolates: analysis of the top-ranked antibiotic-resistant bacteria on the 2017 WHO priority list. J Antimicrob Chemother. 2019 Dec 1;74(12):3619-3625.
- Collignon P., Beggs J.J., Walsh T.R., Gandra S., Laxminarayan R. Anthropological and socioeconomic factors contributing to global antimicrobial resistance: a univariate and multivariable analysis. Lancet Planet Health. 2018 Sep;2(9): e398-e405.
- Patel J., Harant A., Fernandes G., Mwamelo A.J., Hein W., Dekker D., Sridhar D. Measuring the global response to antimicrobial resistance, 2020-21: a systematic governance analysis of 114 countries. Lancet Infect Dis. 2023 Jun;23(6):706-718.
- https://moz.gov.ua/uk/decrees/nakaz-moz-ukraini-vid‑23082023-1513-pro-zatverdzhennja-standartu-medichnoi-dopomogi-racionalne-zastosuvannja-antibakterialnih-i-antifungalnih-preparativ-z-likuvalnoju-ta-profilaktichnoju-metoju
- Boni S., Marin G.H., Campaсa L., Marin L., Risso-Patrуn S., Marin G., Gabriel F., Corso A., Garay V., Limeres M. Association between Consumption of Fluoroquinolones and Carbapenems and Their Resistance Rates in Pseudomonas aeruginosa in Argentina. Interdiscip Perspect Infect Dis. 2022.
- Pakyz A.L., Oinonen M., Polk R.E. Relationship of carbapenem restriction in 22 university teaching hospitals to carbapenem use and carbapenem-resistant Pseudomonas aeruginosa. Antimicrob Agents Chemother. 2009 May;53(5):1983-6.
- Доповідь Романа Колесника, керівника відділу антимікробної резистентності та інфекційного контролю ІІ Всеукраїнський з’їзд учасників національної мережі дозорного епідеміологічного нагляду за резистентністю до антимікробних препаратів, 1 травня 2024 року, м. Київ.
- Harris E. Antimicrobial Resistance Is Rising in Ukraine and Neighboring Areas. JAMA. 2024 Jan 9;331(2):101.
- Berger F.K., Schmartz G.P., Fritz T., Veith N., Alhussein F., Roth S., Schneitler S., Gilcher T., Gдrtner B.C., Pirpilashvili V., Pohlemann T., Keller A., Rehner J., Becker S.L. Occurrence, resistance patterns, and management of carbapenemase-producing bacteria in war-wounded refugees from Ukraine. Int J Infect Dis. 2023 Jul;132:89-92.
- https://publichealth.com.ua/program/public-health-center
- Marco Falcone, George L Daikos, Giusy Tiseo, Dimitrios Bassoulis, Cesira Giordano, Valentina Galfo, Alessandro Leonildi, Enrico Tagliaferri, Simona Barnini, Spartaco Sani, Alessio Farcomeni, Lorenzo Ghiadoni, Francesco Menichetti, Efficacy of Ceftazidime-avibactam Plus Aztreonam in Patients With Bloodstream Infections Caused by Metallo-β-lactamase – Producing Enterobacterales, Clinical Infectious Diseases, Volume 72, Issue 11, 1 June 2021, P. 1871-1878.
- Moshynets O.V., Baranovskyi T.P., Cameron S., Iungin O.S., Pokholenko I., Jerdan R., Kamyshnyi A., Krikunov A.A., Potochilova V.V., Rudnieva K.L., Spiers A.J. Azithromycin possesses biofilm-inhibitory activity and potentiates non-bactericidal colistin methanesulfonate (CMS) and polymyxin B against Klebsiella pneumonia. PLoS One. 2022 Jul 1;17(7): e0270983.
- Sree R.A., Gupta A., Gupta N., Veturi S., Reddy L.S.K., Begum M., Shravani E., Challa H.R., Reddy S.S., Singamsetty A., Arumilli M., Reddy P.N., Tirlangi P.K. Ceftazidime-avibactam alone or in combination with Aztreonam versus Polymyxins in the management of carbapenem-Resistant Klebsiella pneumoniae nosocomial Infections (CAPRI study): a retrospective cohort study from South India. Infection. 2024 Apr;52(2):429-437
- Dunne M.W., Aronin S.I., Das A.F., Akinapelli K., Breen J., Zelasky M.T., Puttagunta S. Sulopenem for the Treatment of Complicated Urinary Tract Infections Including Pyelonephritis: A Phase 3, Randomized Trial. Clin Infect Dis. 2023 Jan 6;76(1):78-88.
- https://www.ema.europa.eu/en/medicines/human/EPAR/fetcroja
- https://www.ema.europa.eu/en/medicines/human/EPAR/emblaveo
- https://www.ema.europa.eu/en/medicines/human/EPAR/zerbaxa
- https://contracting.nszu.gov.ua/kontraktuvannya/kontraktuvannya‑2025/proect-vymogy-pmg‑2025.
- Harris H., Tao L., Jacobs E.B., Bergman Y., Adebayo A., Tekle T., Lewis S., Dahlquist A., Abbey T.C., Wenzler E., Humphries R., Simner P.J. Multicenter Evaluation of an MIC-Based Aztreonam and Ceftazidime-Avibactam Broth Disk Elution Test. J Clin Microbiol. 2023 May 23;61(5): e0164722.
- Moshynets O.V., Spiers A.J. Viewing Biofilms within the Larger Context of Bacterial Aggregations [Internet]. Microbial Biofilms – Importance and Applications. InTech; 2016.
- Brice Daragon, Damien Fournier, Patrick Plйsiat, Katy Jeannot, Performance of disc diffusion, MIC gradient tests and Vitek 2 for ceftolozane/tazobactam and ceftazidime/avibactam susceptibility testing of Pseudomonas aeruginosa, Journal of Antimicrobial Chemotherapy, Volume 76, Issue 10, October 2021, Pages 2586-2592
- Moshynets O.V., Baranovskyi T.P., Cameron S., Iungin O.S., Pokholenko I., Jerdan R., Kamyshnyi A., Krikunov A.A., Potochilova V.V., Rudnieva K.L., Spiers A.J. Azithromycin possesses biofilm-inhibitory activity and potentiates non-bactericidal colistin methanesulfonate (CMS) and polymyxin B against Klebsiella pneumonia. PLoS One. 2022 Jul 1;17(7): e0270983.
- Moshynets O.V.; Baranovskyi T.P.; Iungin O.S.; Krikunov A.A.; Potochilova V.V.; Rudnieva K.L.; Potters G.; Pokholenko I. Therapeutic Potential of an Azithromycin-Colistin Combination against XDR K. pneumoniae in a 3D Collagen-Based In Vitro Wound Model of a Biofilm Infection. Antibiotics 2023, 12, 293.
- Cornforth D.M., Dees J.L., Ibberson C.B., Huse H.K., Mathiesen I.H., Kirketerp-Mшller K., Wolcott R.D., Rumbaugh K.P., Bjarnsholt T., Whiteley M. Pseudomonas aeruginosa transcriptome during human infection. Proc Natl Acad Sci U S A. 2018 May 29;115(22): E5125-E5134.
- Daragon B., Fournier D., Plйsiat P., Jeannot K. Performance of disc diffusion, MIC gradient tests and Vitek 2 for ceftolozane/tazobactam and ceftazidime/avibactam susceptibility testing of Pseudomonas aeruginosa. J Antimicrob Chemother. 2021 Sep 15;76(10):2586-2592.
- Harris H., Tao L., Jacobs E.B., Bergman Y., Adebayo A., Tekle T., Lewis S., Dahlquist A., Abbey T.C., Wenzler E., Humphries R., Simner P.J. Multicenter Evaluation of an MIC-Based Aztreonam and Ceftazidime-Avibactam Broth Disk Elution Test. J Clin Microbiol. 2023 May 23;61(5): e0164722.
- J.Q.M. Teo, J.H. Toh, T.P. Lim, W. Lee, J.J.Y. Ho, H.Y. Chang, S.H. Tan, Z.W. Ong, T.H. Koh, P. Chlebicki, S.J. Chung, B.H. Tan, T.T. Tan, A.L. Kwa. Bactericidal combination regimens against carbapenem-resistant Pseudomonas aeruginosa: treatment and outcomes. – O1175, ESCMID Global 2024, 27-30 April 2024 in Barcelona, Spain
- Cai Y., Chua N.G., Lim T.P,. Teo J.Q., Lee W., Kurup A., Koh T.H., Tan T.T., Kwa A.L. From Bench-Top to Bedside: A Prospective In Vitro Antibiotic Combination Testing (iACT) Service to Guide the Selection of Rationally Optimized Antimicrobial Combinations against Extensively Drug Resistant (XDR) Gram Negative Bacteria (GNB). PLoS One. 2016 Jul 21;11(7): e0158740.
- Gomes M.Z.R., de Lima E.M., Martins Aires C.A., Pereira P.S., Yim J., Silva F.H., Rodrigues C.A.S., Oliveira T.R.T.E., da Silva P.P., Eller C.M., de Souza C.M.R., Rybak M.J., Albano R.M., de Miranda A.B., Machado E., Catanho M.; Nucleus of Hospital Research (NPH) study collaborators. Outbreak report of polymyxin-carbapenem-resistant Klebsiella pneumoniae causing untreatable infections evidenced by synergy tests and bacterial genomes. Sci Rep. 2023 Apr 17;13(1):6238.
- Singh-Moodley A., Perovic O. Phenotypic and genotypic correlation of carbapenememase-producing Enterobacteriaceae and problems experienced in routine screening. S Afr Med J. 2018 May 25;108(6):495-501.
- https://www.eucast.org/
- European Committee for Antimicrobial Susceptibility Testing (EUCAST) of the European Society of Clinical Microbiology and Infectious Dieases (ESCMID). EUCAST Definitive Document E.Def 1.2, May 2000: Terminology relating to methods for the determination of susceptibility of bacteria to antimicrobial agents. Clin Microbiol Infect. 2000 Sep;6(9):503-8.
- Lorian V., 2005. Antibiotics in laboratory medicine. Philadelphia: Lippincott Williams and Wilkins.
- Pena-Miller R., Laehnemann D., Jansen G., Fuentes-Hernandez A., Rosenstiel P., Schulenburg H., Beardmore R. When the most potent combination of antibiotics selects for the greatest bacterial load: the smile-frown transition. PLoS Biol. 2013;11(4): e1001540.
- He L., Lv H., Wang Y., Jiang F., Liu Q., Zhang F., Wang H., Shen H., Otto M., Li M. Antibiotic treatment can exacerbate biofilm-associated infection by promoting quorum cheater development. NPJ Biofilms Microbiomes. 2023 May 18;9(1):26.
- Shenkutie A.M., Zhang J., Yao M., Asrat D., Chow F.W.N., Leung P.H.M. Effects of Sub-Minimum Inhibitory Concentrations of Imipenem and Colistin on Expression of Biofilm-Specific Antibiotic Resistance and Virulence Genes in Acinetobacter baumannii Sequence Type 1894. Int J Mol Sci. 2022 Oct 21;23(20):12705.
- Moshynets O.V.; Baranovskyi T.P.; Iungin O.S.; Krikunov A.A.; Potochilova V.V.; Rudnieva K.L.; Potters G.; Pokholenko I. Therapeutic Potential of an Azithromycin-Colistin Combination against XDR K. pneumoniae in a 3D Collagen-Based In Vitro Wound Model of a Biofilm Infection. Antibiotics 2023, 12, 293.
- Kumar A., Saha S.K., Banerjee P., Prasad K., Sengupta T.K. Antibiotic-Induced Biofilm Formations in Pseudomonas aeruginosa Strains KPW.1-S1 and HRW.1-S3 are Associated with Increased Production of eDNA and Exoproteins, Increased ROS Generation, and Increased Cell Surface Hydrophobicity. Curr Microbiol. 2023 Nov 17;81(1):11.
Тематичний номер «Хірургія. Ортопедія. Травматологія. Інтенсивна терапія» № 1 (63), 2025 р.



