13 вересня, 2024
Застосування статинів у пацієнта з коморбідністю ССЗ і МАЖХП
Проатерогенна дисліпідемія, а саме підвищений рівень холестерину ліпопротеїнів низької щільності (ХС ЛПНЩ) і залишкового холестерину, який переносять збагачені на тригліцериди ліпопротеїни, є провідним фактором ризику атеросклеротичних серцево-судинних захворювань (ССЗ) (Sandesara P.B. et al., 2019). Слід зауважити, що дисліпідемія тісно асоціюється не лише із ССЗ, а й з ендокринологічними патологіями (ожиріння, цукровий діабет (ЦД) 2 типу, метаболічний синдром) і неалкогольною жировою хворобою печінки (НАЖХП) (Manikat R., Nguyen M.H., 2023), крім того, належить до найпоширенішого кластера хвороб – кардіометаболічного, а також є типовою ознакою коморбідного пацієнта.
НАЖХП стала найпоширенішою причиною хронічних хвороб печінки в усьому світі: в наш час НАЖХП уражає до 38% дорослих осіб світу. Очікується, що впродовж наступної декади загальносвітова розповсюдженість НАЖХП зросте ще більше паралельно з пандемією ожиріння і ЦД 2 типу (Wong V.-S. et al., 2023; Karlsen T.H. et al., 2022).
За останні 10-15 років у розумінні НАЖХП відбулися значні концептуальні зміни, зокрема, було визнано, що НАЖХП – мультисистемне захворювання, в розвитку якого ключові патогенетичні ролі відіграють інсулінорезистентність та асоційована з нею метаболічна дисфункція (Byrne C.D., Targher G., 2015; Targher G. et al., 2021; Adams L.A. et al., 2017). Саме тому запропоновано змінити термінологію і визначення НАЖХП із переходом на коректніші терміни – метаболічно-асоційована жирова хвороба печінки (МАЖХП) і метаболічно-асоційований стеатогепатит (МАСГ), які точніше відображають патофізіологію процесу та його кардіометаболічний контекст (Eslam M. et al., 2020; Rinella M.E. et al., 2023). Підраховано, що ≈99% осіб із НАЖХП відповідають критеріям МАЖХП (Hagström H. et al., 2023).
Причинами розвитку МАЖХП є відповідне генетичне підґрунтя, різноманітні метаболічні дисфункції (вісцеральне ожиріння, ЦД), дисбіоз кишечнику, надмірне споживання фруктози та холестерину, вживання алкоголю, забруднення довкілля тощо. МАЖХП, якій притаманне внутрішньопечінкове накопичення тригліцеридів >5% маси, – спектр хвороб. Так, початковою стадією є стеатоз печінки (fatty liver), надалі виникає МАСГ, якому властиві зміни архітектури печінкових часточок, ушкодження, запалення та балонна дегенерація гепатоцитів, формування ацидофільних апоптотичних тілець, незначне хронічне перипортальне запалення і фіброз, перисинусоїдальні відкладення колагену тощо. Фінальна стадія МАСГ – макронодулярний цироз. Прогресування МАСГ до цирозу спостерігається в ≈22% пацієнтів. Своєю чергою, в осіб із тяжким цирозом може розвиватися гепатоцелюлярна карцинома (рис. 1) (Portincasa P. et al., 2024).
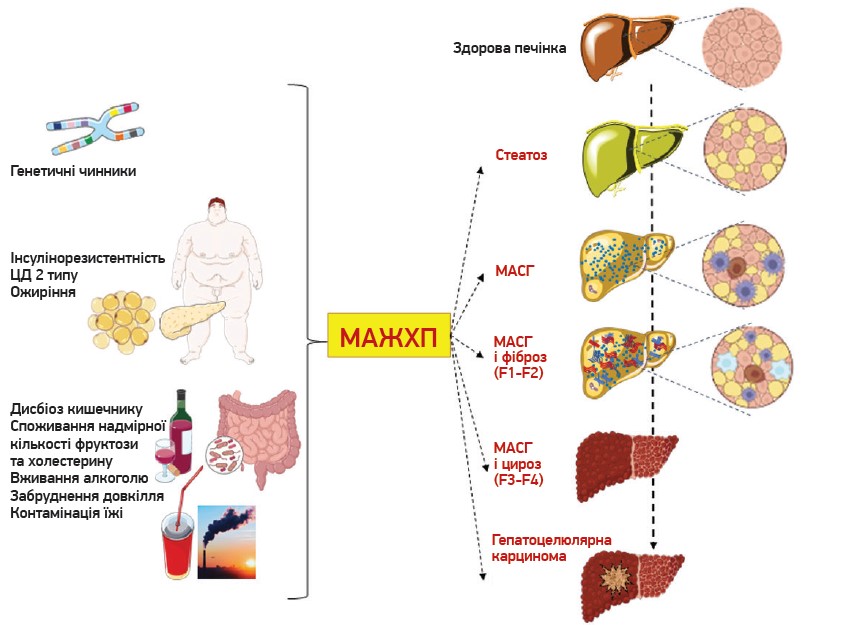
Рис. 1. Етіологічні чинники МАЖХП і зміни печінки при різних формах цього патологічного стану (Portincasa P. et al., 2024)
Примітки:
F1 – портальний фіброз без септ;
F2 – портальний фіброз із декількома септами;
F3 – численні септи без цирозу;
F4 – цироз.
МАЖХП як фактор ризику ССЗ
МАЖХП – незалежний фактор ризику ССЗ, які є провідною причиною смерті осіб із цим станом (Adams L.A. et al., 2017; Angulo P. et al., 2015). За результатами метааналізу А. Mantovani та співавт. (2021), який включав 36 досліджень за участю ≈5,8 млн осіб середнього віку, дійшли висновку, що МАЖХП асоціюється зі збільшенням ризику фатальних і нефатальних серцево-судинних подій у 1,45 раза. Аналогічні дані отримано і в інших масштабних метааналізах (Lee H.-H. et al., 2024; Chen J. et al., 2023). Переконлива доказова база свідчить, що МАЖХП не лише сприяє прискоренню коронарного атеросклерозу, а й підвищує ризик гіпертрофії та діастолічної дисфункції лівого шлуночка, кальцифікації клапанів серця і розвитку аритмій (переважно постійної форми фібриляції передсердь), а також приблизно в 1,5 раза збільшує імовірність розвитку серцевої недостатності (Anstee Q.M. et al., 2018; Yong J.N. et al., 2022; Di Minno M.N. et al., 2016; Mantovani A. et al., 2019; Cai X. et al., 2020; Mantovani A. et al., 2023).
Лікування МАЖХП
Лікування МАЖХП слід розпочинати з модифікації способу життя – відмови від куріння та переходу на здорове харчування з високим умістом овочів, фруктів, горіхів і мінімально оброблених цільних злаків. Необхідно також зменшити споживання трансжирів, червоного та обробленого м’яса, оброблених вуглеводів, цукрози, фруктози і підсолоджених напоїв, споживаючи натомість пісне м’ясо й рибу. Більшість пацієнтів із МАЖХП мають надмірну масу тіла / ожиріння, тому доцільно обмежити загальну калорійність раціону. Питання вживання алкоголю дотепер обговорюється, але з огляду на його несприятливий вплив на кардіоваскулярний ризик доцільно рекомендувати особам із МАЖХП утриматися від споживання алкогольних напоїв. Слід заохочувати пацієнтів до ≥150 хв помірно інтенсивної або 75 хв інтенсивної фізичної активності на тиждень (Arnett D.K. et al., 2019).
Під час обрання фармакотерапії за МАЖХП необхідно звернути увагу на препарати, ефект яких здатен зменшувати вираженість кардіометаболічних факторів ризику (насамперед артеріальної гіпертензії, проатерогенної дисліпідемії, дисглікемії, абдомінального ожиріння). Так, у разі 10-річного ризику кардіоваскулярних подій ≥7,5% доцільно призначати статини. Також доцільним може бути призначення засобів, спрямованих на лікування ЦД 2 типу, наприклад агоністів рецепторів глюкагоноподібного пептиду‑1, інгібіторів натрійглюкозного котранспортера 2 типу, піоглітазону, інгібіторів ренін-ангіотензин-альдостеронової системи (рис. 2) (Targher G. et al., 2024).
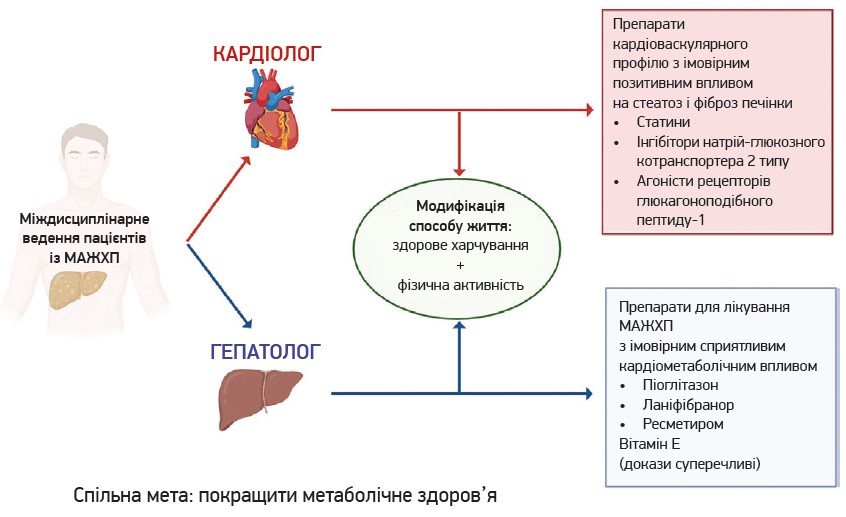
Рис. 2. Міждисциплінарне ведення пацієнтів із МАЖХП
Статинотерапія при МАЖХП
Відповідно до рекомендацій з клінічної практики Європейської асоціації з вивчення печінки, Європейської асоціації з вивчення діабету та Європейської асоціації з вивчення ожиріння (EASL-EASD-EASO, 2024), МАЖХП індукує атерогенну дисліпідемію, тому для профілактики кардіоваскулярних подій у таких випадках часто показана статинотерапія. Безпека статинів в осіб із МАЖХП добре доведена та не асоціюється з підвищеним ризиком гепатотоксичності.
Зазвичай МАЖХП супроводжується проатерогенним ліпідним фенотипом, який передбачає підвищений уміст ХС ЛПНЩ у поєднанні зі зниженим умістом холестерину ліпопротеїнів високої щільності (ХС ЛПВЩ) і підвищеним – тригліцеридів. Іноді в пацієнтів із МАЖХП спостерігається нормальна концентрація ХС ЛПНЩ, але і в цій ситуації застосування статинів здатне знизити серцево-судинний ризик (Targher G. et al., 2024).
Статинотерапія є основним заходом первинної профілактики ССЗ в осіб підвищеного ризику. В рекомендаціях Американської колегії кардіологів та Американської асоціації серця з питань первинної профілактики (2019) зазначено, що статинотерапія необхідна всім пацієнтам із 10-річним кардіоваскулярним ризиком на рівні ≥7,5%. Статини чинять сприятливий вплив і на стан серцево-судинної системи, і на стан печінки (табл.) (Raggi P. et al., 2024).
|
Таблиця. Статини при МАЖХП |
||||
|
Препарати |
Механізм дії |
Показання |
Вплив на печінку в осіб із МАЖХП/ МАСГ |
Кардіометаболічний вплив |
|
Статини |
Інгібування гідроксиметилглутарил- |
Первинна та вторинна кардіоваскулярна профілактика; зниження вмісту ліпідів |
Імовірний сприятливий вплив на стеатоз і фіброз печінки |
Первинна та вторинна профілактика ССЗ, зниження вмісту ліпідів, зменшення частоти кардіоваскулярних подій, зниження показників смертності |
Масштабне дослідження «випадок – контроль» продемонструвало, що вживання статинів асоціюється зі зниженням ризику МАЖХП (відносний ризик (ВР) 0,66; 95% довірчий інтервал (ДІ) 0,65-0,67) і фіброзу печінки (ВР 0,43; 95% ДІ 0,42-0,44). У цьому дослідженні взяли участь >11,5 млн осіб, за якими спостерігали протягом 6 років. Наявність МАЖХП діагностували на основі розрахунку індексу жирної печінки (fatty liver index, FLI), а фіброз печінки – за шкалою BARD. Важливо, що сприятливий вплив статинів на стан печінки не залежав від наявності в пацієнта ЦД (Lee J.I. et al., 2021; Ayada I. et al., 2023). Н.В. El-Serag і співавт. (2009) також провели дослідження «випадок – контроль» за участю 6515 хворих із ЦД і з’ясували, що призначення статинотерапії зменшувало імовірність розвитку гепатоцелюлярної карциноми на 26% (ВР 0,74; 95% ДІ 0,64-0,87). На результат не впливала наявність фонових хвороб печінки. Ці висновки підтвердив і метааналіз М.М. Islam та співавт. (2020), який виявив, що ризик виникнення гепатоцелюлярної карциноми та смертність були нижчими в тій підгрупі осіб із МАЖХП, яка приймала статини. Навіть в осіб із підтвердженим біопсією НАСГ застосування статинів асоціювалося із меншою імовірністю розвитку стеатозу печінки та фіброзу печінки стадій F2-F4 (Dongiovanni P. et al., 2015).
Дослідження за участю пацієнтів із ЦД 2 типу, які не були носіями вірусів гепатиту В та С, виявило, що застосування статинів достовірно знижувало ризик розвитку декомпенсованого цирозу печінки в цій популяції (ВР 0,65; 95% ДІ 0,61-0,70) (Wu S.-Y. et al., 2023). Загалом за компенсованого цирозу статини є безпечними, однак у разі декомпенсованого цирозу їх уже не рекомендують, оскільки ймовірність отримання переваг статинотерапії на цій стадії захворювання печінки є низькою, а ризик накопичення препарату із критичним підвищенням його вмісту в сироватці крові – високим (Speliotes E.K. et al., 2018).
Статини не знижують уміст жиру в печінці самі собою, але зменшують асоційований з НАЖХП ризик завдяки своїм ліпідознижувальним, протизапальним, антиоксидантним та антифібротичним властивостям (Ayada I. et al., 2023; Tzanaki I. et al., 2022). Вільний неестерифікований холестерин сприяє активації прозапальних і профібротичних біохімічних каскадів, які запускають прогресування НАЖХП до НАСГ та/або цирозу печінки (Lonardo A. et al., 2021). Знижуючи вміст холестерину в циркулювальній крові, статини опосередковано протидіють цьому прогресуванню. Крім того, для статинів продемонстрована здатність знижувати експресію прозапальних і профібротичних медіаторів. Так, розувастатин достовірно пригнічує експресію фактора некрозу пухлини α, інтерлейкінів 6 і 1β, інтерферону γ та трансформувального фактора росту β1 в експериментальній моделі гепатоцелюлярної карциноми. На думку авторів експерименту, розувастатин є потенційним протекторним препаратом, здатним запобігати розвитку гепатоцелюлярної карциноми в пацієнтів з НАЖХП/НАСГ (Yokohama K. et al., 2019). Описано ще два механізми, які лежать в основі антифібротичної дії статинів: здатність запобігати активації зірчастих клітин печінки та знижувати тиск у портальній системі (Bravo M. et al., 2019; Chong L.W. et al., 2015).
У рандомізованому клінічному дослідженні G. Sfikas і співавт. (2021) пацієнтів із МАЖХП/МАСГ було розподілено на групи дієти та фізичних навантажень або статинотерапії на 1 рік. Лікування статинами достовірно зменшувало вираженість стеатозу печінки за шкалою активності МАЖХП і фіброзу печінки за шкалою FIB‑4. Продемонстровано також, що статини зменшують портальну гіпертензію та смертність у пацієнтів із хронічними хворобами печінки і ризик раку печінки в осіб із МАЖХП (Gratacós-Ginès J., Pose E., 2023: Zou B. et al., 2023).
1 серпня опубліковано результати когортного дослідження за участю 7988 пацієнтів із МАЖХП, яким щонайменше двічі проводили еластографію печінки. 40,5% учасників випробування приймали статини. Через 4,6 року спостереження виявилося, що застосування статинів достовірно асоціювалося з нижчим ризиком смерті від усіх причин (ВР 0,233; 95% ДІ 0,127-0,426) та клінічних подій з боку печінки (ВР 0,380; 95% ДІ 0,268-0,539). Крім того, вживання статинів супроводжувалося повільнішим наростанням жорсткості печінки в осіб із компенсованими пізніми стадіями хронічних хвороб цього органа (Zhou X.-D. et al., 2024). Цікаво, що для протекторного ефекту статинів стосовно НАЖХП важливе значення має висока прихильність пацієнтів (застосування цих препаратів у ≥80% днів) (Nakagawa C. et al., 2022).
Хоча статини рекомендовані хворим із високим ризиком МАЖХП (включаючи осіб із ЦД, ожирінням, метаболічним синдромом) для профілактики кардіоваскулярних подій, ці препарати призначають недостатньо. Опубліковані дані свідчать про те, що ≈50% хворих із МАЖХП і чіткими показаннями до прийому статинів, а також до 33% осіб із клінічно вираженими атеросклеротичними ССЗ не отримують цих препаратів (Thomson M.J. et al., 2022; Shahab O. et al., 2018).
Статини та езетиміб у разі МАЖХП
Узагальнювальний аналіз рандомізованих контрольованих досліджень підтверджує, що комбінація статинів і езетимібу зменшує кількість кардіоваскулярних подій у пацієнтів із МАЖХП. Цікаво, що в хворих із МАЖХП переваги статинів є навіть вираженішими, ніж в осіб без МАЖХП (Athyros V.G. et al., 2010; Simon T.G. et al., 2018).
Езетиміб зменшує усмоктування холестерину в кишечнику та при додаванні до статинів чинить додатковий знижувальний ефект щодо ХС ЛПНЩ і тригліцеридів (Cho Y. et al., 2022; Trinh M.N. et al., 2018; Cannon C.P. et al., 2015). Субаналіз відомого дослідження IMPROVE-IT продемонстрував, що додавання езетимібу до статину має додатковий протекторний вплив в осіб із МАЖХП/МАСГ. Так, у пацієнтів із НАЖХП і високим ступенем фіброзу печінки спостерігався на 30% вищий ризик кардіоваскулярних подій (серцево-судинної смерті, інфаркту міокарда, нестабільної стенокардії, реваскуляризації або інсульту). У хворих із високим ступенем фіброзу комбінація статин/езетиміб забезпечувала зниження абсолютного ризику повторних кардіоваскулярних подій на 3,7% порівняно з комбінацією статин/плацебо. Автори пропонують проводити оцінку ступеня фіброзу в усіх пацієнтів серцево-судинного профілю, оскільки особи з обумовленим НАЖХП фіброзом печінки отримують найвираженіші переваги від подвійної ліпідознижувальної терапії (Simon T.G. et al., 2018). Сприятливий вплив езетимібу на стан печінки було підтверджено і в дослідженнях, які передбачали біопсію цього органа. Так, у дослідженні Y. Takeshita та співавт. (2014) застосування езетимібу асоціювалося зі зменшенням фіброзу печінки і балонної дистрофії гепатоцитів.
Розуліп® і Розуліп® Плюс – засоби подолання дисліпідемії
Продемонстровано, що розувастатин здатен дещо знижувати вміст аланін- та аспартатамінотрансферази, водночас зменшуючи вираженість фіброзу печінки. K. Kargiotis і співавт. (2014, 2015) призначали розувастатин у дозі 10 мг/добу пацієнтам із дисліпідемією, метаболічним синдромом та підтвердженим біопсією НАСГ. Повторна біопсія та ультразвукове дослідження печінки через 12 міс виявили повне зникнення ознак НАСГ (стеатоз, некротичне запалення, фіброз) у 5 із 6 учасників. Водночас застосування розувастатину асоціювалося зі зниженням активності аланінамінотрансферази на 76%, аспартатамінотрансферази – на 61%. У цьому дослідженні виявлено ще одну перевагу розувастатину: його сприятливий кардіометаболічний вплив, який полягав у достовірному зниженні вмісту сечової кислоти в сироватці крові та рівня глюкози плазми крові натще.
Схожі результати отримали T. Nakahara та співавт. (2012), у дослідженні яких взяли участь пацієнти з підтвердженим біопсією НАСГ і дисліпідемією, які протягом 24 міс отримували розувастатин. Наприкінці випробування в 33,3% хворих спостерігалося зниження активності НАЖХП, а в 33,3% – зменшення ступеня фіброзу. В 33,3 та 55,6% учасників відповідно ці показники залишилися сталими, а це є свідченням того, що розувастатин протидіє прогресуванню НАЖХП. Нормалізацію рівня печінкових ферментів на тлі прийому розувастатину відзначили і S. Antonopoulos та співавт. (2006), у дослідженні котрих пацієнти з НАЖХП й дисліпідемією отримували розувастатин у дозі 10 мг/добу протягом 8 міс. Такі результати обумовлюють доцільність застосування при НАЖХП і дисліпідемії саме цього статину.
Під час обрання препарату розувастатину варто довіритися надійному виробнику з хорошою репутацією. Так, Розуліп® (фармацевтичний завод «Егіс», Угорщина) – європейський розувастатин, представлений у найчастіше застосовуваних дозах 10 та 20 мг. Також у цій лінійці препаратів наявний Розуліп® Плюс – комбінація 10 або 20 мг розувастатину з 10 мг езетимібу. Наявність різних доз розувастатину та підсиленої езетимібом гіполіпідемічної комбінації надає лікарю можливість обрати оптимальну для кожного пацієнта інтенсивність ліпідознижувальної терапії.
Підготувала Лариса Стрільчук
Медична газета «Здоров’я України 21 сторіччя» № 15 (576), 2024 р



