29 грудня, 2023
BRCA-асоційований рак грудної залози: оптимізація діагностики та лікування відповідно до сучасних даних
Рак грудної залози (РГЗ) залишається найпоширенішим онкологічним захворюванням у жіночого населення. У 5-7% випадків він має спадковий характер і пов’язаний з мутаціями у генах BRCA1 та BRCA2. Такі пухлини характеризуються агресивним перебігом, молодим віком пацієнток, високою ймовірністю розвитку метастазів та рецидиву. У рамках другої секції конференції «РГЗ. Майбутнє сьогодні» було висвітлено сучасні аспекти персоналізованого ведення пацієнток з РГЗ з фокусом на важливості генетичного тестування та можливостях цільової терапії.
 Другу секцію конференції з питань сучасної онкології відкрила Любов Андріївна Сивак, доктор медичних наук, професор, клінічний онколог, керівниця відділу солідних пухлин ДНП «Національний інститут раку» (м. Київ) доповіддю «BRCAm-acоційований РГЗ: які особливості його перебігу?».
Другу секцію конференції з питань сучасної онкології відкрила Любов Андріївна Сивак, доктор медичних наук, професор, клінічний онколог, керівниця відділу солідних пухлин ДНП «Національний інститут раку» (м. Київ) доповіддю «BRCAm-acоційований РГЗ: які особливості його перебігу?».
– Мутації генів BRCA визначаються як найпоширеніші при спадковому РГЗ (D.G. Evans, 2018; Breast Cancer Association Consortium, 2021). Пацієнти з BRCA-асоційованим РГЗ становлять унікальну щодо характеристик пухлини популяцію (Z. Baretta, 2016; Y. Song, 2020). Насамперед відзначаються дуже високі темпи росту злоякісного новоутворення. Так, подвоєння розмірів пухлини відбувається вдвічі швидше при BRCA-асоційованому РГЗ, ніж у пацієнток, які не є носіями таких аномалій (M.M. Tilanus-Linthorst, 2005). Це пов’язано зі специфічними генетичними дефектами, що призводять до неконтрольованої проліферації клітин.
За результатами ретроспективного аналізу у пацієнтів з гермінальними мутаціями генів BRCA (gBRCAm) частіше виявляли вищий ступінь злоякісності пухлини порівняно з пацієнтами з мутаціями BRCA «дикого» типу (BRCAwt; M. Aleskandarany, 2015). Крім того, у пацієнтів з gBRCAm відзначено також вищий рівень маркера проліферації (поділу) клітин (Кі-67). При аналізі багатоцентрової французької бази даних хворих на РГЗ виявлено, що пацієнти з gBRCAm частіше (р=0,008) мають ≥3 вогнищ метастазування, ніж пацієнти з BRCAwt або особи, яким не проводили тестування (A. Mailliez, 2021).
Сучасні дані свідчать, що пацієнтам з gBRCAm зазвичай діагноз РГЗ встановлюють у молодшому віці, ніж тим, у кого захворювання є спорадичним. Середній вік на момент встановлення діагнозу складає від 35 до 44 років при мутаціях гена BRCA1, 40-45 років при мутаціях гена BRCA2, тоді як у разі спорадичного РГЗ (не пов’язаний з мутаціями BRCA) він становить 54 роки (N. Mavaddat, 2012; S. Becourt, 2018; F. Fostira, 2016).
Характерною ознакою РГЗ з мутаціями BRCA є схильність до раннього метастазування, частіше спостерігаються віддалені метастази в головному мозку, кістках, печінці, легенях. Також відзначається високий ризик (до 40%) розвитку пухлини у контралатеральній залозі після органозбережної операції порівняно з пацієнтами з РГЗ і BRCAwt (M.L. Riis, 2021; Е. Molina-Montes, 2016; V. Giannakeas, 2021).
Отже, пацієнти з BRCA-асоційованим РГЗ становлять окрему групу, якій притаманні агресивна форма захворювання, його початок у більш молодому віці, вищий ризик метастазування та рецидивів. Саме тому тестування та виявлення спадкових мутацій набуває такого великого значення для подальшої оптимізації лікування та моніторингу пацієнтів цієї групи.
 Ярослав Васильович Шпарик, кандидат медичних наук, доцент, завідувач відділення хіміотерапії КНП ЛОР «Львівський онкологічний регіональний лікувально-діагностичний центр» представив доповідь «Новий етап у персоналізованій терапії раннього BRCA-асоційованого РГЗ: чи є шанс на виліковування?».
Ярослав Васильович Шпарик, кандидат медичних наук, доцент, завідувач відділення хіміотерапії КНП ЛОР «Львівський онкологічний регіональний лікувально-діагностичний центр» представив доповідь «Новий етап у персоналізованій терапії раннього BRCA-асоційованого РГЗ: чи є шанс на виліковування?».
– У носіїв мутацій BRCA1/2 ризик прогресування захворювання та метастазування після стандартного лікування значно вищий. Зокрема, BRCA-асоційований РГЗ характеризується агресивнішим фенотипом, вищим ризиком рецидиву, ніж за відсутності мутацій у цьому гені. Саме тому виявлення мутацій гена BRCA вкрай важливе для подальшої оптимізації терапії. За сучасними рекомендаціями, BRCA-статус допомагає прийняти рішення про хірургічне втручання та медикаментозну терапію.
У настановах Європейського товариства медичної онкології та Європейської школи онкології (ESMO/ESO) зазначено, що тестування на gBRCAm слід пропонувати пацієнтам із раннім РГЗ у групах високого ризику (C. Sessa, 2023). Відповідно до рекомендацій Національної онкологічної мережі США (NCCN), тестування клінічно показане пацієнтам ≤50 років та пацієнтам з обтяженим сімейним анамнезом при наявності тричі негативного раку грудної залози (ТНРГЗ), множинного первинного РГЗ, лобулярного РГЗ, РГЗ у чоловіків та пацієнтам єврейського походження (ашкеназі; F. Cardoso, 2019; NCCN, 2023).
У багатоцентровому рандомізованому плацебо-контрольованому дослідженні III фази OlympiA оцінювали ефективність застосування інгібітора полі(АДФ-рибози)-полімераз людини (PARP) олапарибу проти плацебо в ад’ювантній терапії РГЗ за відсутності людського епідермального фактора росту (HER2-), з наявністю gBRCAm і високим ризиком рецидиву (A.N.J. Tutt, 2021). Пацієнти мали завершити принаймні 6 циклів неоад’ювантної чи ад’ювантної хіміотерапії (ХТ), яка складалася з антрациклінів, таксанів чи обох класів препаратів. Дозволялася попередня терапія препаратами платини з приводу попереднього раку (наприклад, раку яєчника) чи ад’ювантна або неоад’ювантна терапія з приводу РГЗ. Критерії відбору до дослідження: gBRCAm1/2, РГЗ ІІ-ІІІ стадії, HER2- (HR+ або ТНРГЗ), проходження місцевого лікування та ≥6 циклів неоад’ювантної чи ад’ювантної ХТ на основі антрациклінів та/або таксанів.
Пацієнтів розподілили на 2 групи для отримання стандартного первинного лікування, що включало хірургічне втручання до або після 6 циклів і більше неоад’ювантної/ад’ювантної ХТ з променевою терапією чи без такої. Після завершення місцевого лікування і системної терапії пацієнтів рандомізували у групи для отримання додаткової ад’ювантної терапії олапарибом у дозі 300 мг 2 рази на добу (n=921) або плацебо (n=915) протягом 1 року. Стратифікацію хворих проводили за гормональним статусом пухлини, типом попередньої ХТ (неоад’ювантна чи ад’ювантна) та фактом застосування препаратів платини. Терапія тривала 1 рік або до прогресування захворювання чи розвитку неприйнятної токсичності. Пацієнти з HR+ пухлинами отримували також ендокринну терапію. Централізований аналіз на gBRCAm1 використовували для встановлення придатності пацієнта до участі в дослідженні. Загалом з 1836 учасників, включених у дослідження OlympiA, у 1623 були підтверджені gBRCAm1.
Первинною кінцевою точкою була виживаність без ознак інвазивного захворювання (ВБОІЗ), що становила час від рандомізації до дати розвитку першого рецидиву (рецидив визначався як інвазивний локорегіональний, віддалений рецидив, інвазивний контралатеральний РГЗ, новий рак чи смерть з будь-якої причини). До вторинних кінцевих точок належали загальна виживаність (ЗВ), виживаність без ознак віддаленого метастазування, що визначалася як час від рандомізації до підтвердження першого віддаленого рецидиву РГЗ.
Результати дослідження продемонстрували статистично достовірне покращення ВБОІЗ у групі олапарибу порівняно з групою плацебо. Прийом олапарибу зменшував ризик інвазивного рецидиву або смерті на 42% порівно з плацебо (відношення ризиків – ВР – 0,58; 99,5% довірчий інтервал – ДІ – 0,41-0,82; р<0,0001). Трирічна ВБОІЗ у групі олапарибу становила 85,9%, тоді як у групі плацебо – 77,1% із різницею 8,8% (95% ДІ 4,5-13,0). Чотирирічна ВБОІЗ у групі олапарибу склала 82,7%, у групі плацебо – 75,4%, тобто різниця становила 7,3% (95% ДІ 3,0-11,5) на користь олапарибу.
Відповідно до результатів дослідження OlympiA, застосування олапарибу в ад’ювантній терапії пацієнтів з BRCA-асоційованим РГЗ і високим ризиком рецидиву продемонструвало позитивний вплив на ЗВ, зокрема досягнуто статистично значущого поліпшення ЗВ. Різниця показників 4-річної ЗВ у досліджуваних групах дорівнювала 3,4% на користь олапарибу (рис.).
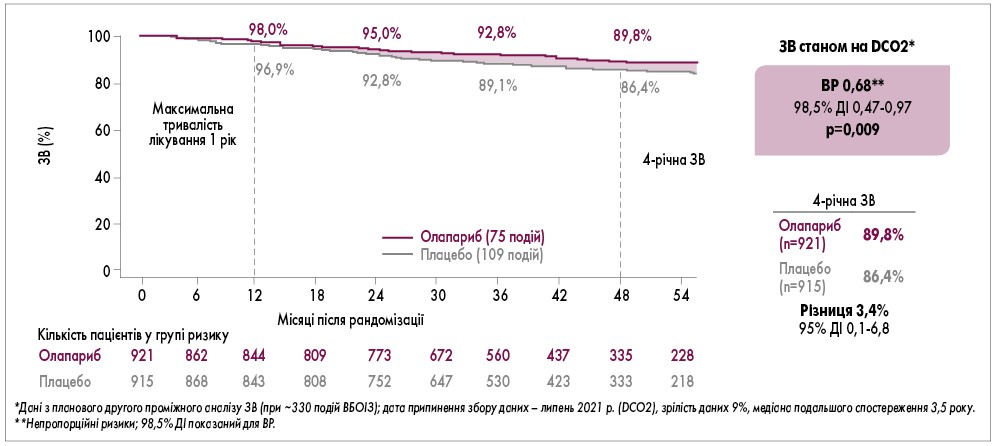 Рис. Значуща користь застосування олапарибу щодо впливу на ЗВ у дослідженні OlympiA
Рис. Значуща користь застосування олапарибу щодо впливу на ЗВ у дослідженні OlympiA
Результати дослідження OlympiA з використання олапарибу у пацієнтів з BRCA-асоційованим РГЗ мають багато спільного з такими історичного дослідження HERA, яке вперше продемонструвало ефективність трастузумабу в ад’ювантній терапії HER2-позитивного РГЗ (D. Cameron, 2017). Відповідно до отриманих результатів, абсолютну користь в 6,0% щодо виживаності без ознак захворювання отримали пацієнти при використанні трастузумабу протягом 1 року. Незважаючи на відносно невелику перевагу, отримані результати радикально змінили клінічну практику: трастузумаб став стандартом лікування HER2-позитивного РГЗ. У дослідженні OlympiA олапариб знижував ризик інвазивного рецидиву на 42%, абсолютна різниця у 3-річній виживаності складала вражаючі 7,3%. Враховуючи ці дані, олапариб має усі шанси повторити успіх трастузумабу та радикально змінити парадигму ад’ювантної терапії BRCA-асоційованого РГЗ.
Таким чином, раннє визначення статусу мутацій генів BRCA1/2 має вирішальне значення при виборі тактики та покращенні віддалених результатів лікування. Дослідження OlympiA стало першим, де продемонстровано ефективність PARP-інгібітора олапарибу як компонента ад’ювантної терапії BRCA-асоційованого HER2- РГЗ високого ризику.
 Микола Федорович Анікусько, кандидат медичних наук, завідувач хірургічного відділення КНП «Київський міський клінічний онкологічний центр» презентував доповідь «На які питання щодо лікування пацієнтів з раннім РГЗ не дають відповідь міжнародні рекомендації?», в якій акцентував увагу на неоад’ювантній терапії HR+/HER2- РГЗ.
Микола Федорович Анікусько, кандидат медичних наук, завідувач хірургічного відділення КНП «Київський міський клінічний онкологічний центр» презентував доповідь «На які питання щодо лікування пацієнтів з раннім РГЗ не дають відповідь міжнародні рекомендації?», в якій акцентував увагу на неоад’ювантній терапії HR+/HER2- РГЗ.
– Пацієнти з BRCA-асоційованим РГЗ становлять унікальну групу, яка потребує розроблення персоналізованого комплексного підходу до лікування з урахуванням генетичних особливостей пухлини. Тестування на наявність мутацій BRCA1/2 має проводитися на початку, адже його результати визначатимуть подальшу стратегію – від вибору режиму неоад’ювантної терапії до обсягу хірургічного втручання та призначення ад’ювантного лікування.
Згідно з чинними рекомендаціями ESMO щодо неоад’ювантної терапії HR+/HER2- РГЗ, лікування слід обирати відповідно до молекулярного підтипу пухлини: у разі люмінального A підтипу РГЗ рекомендовано проводити неоад’ювантну ендокринну терапію; у разі люмінального B підтипу РГЗ показане поєднання неоад’ювантної ендокринної терапії з ХТ. Тобто стратегія передопераційного лікування HR+/HER2- РГЗ має визначатися на підставі чіткої молекулярної характеристики конкретного варіанта пухлини (F. Cardoso, 2019). ХТ у пацієнтів з HR+/HER2- РГЗ загалом рекомендована при низькодиференційованих пухлинах, високому Кі-67, низькому рівні експресії естрогенових та прогестеронових рецепторів, несприятливих генетичних сигнатурах і високому ризику раннього рецидиву. У настанові NCCN (2023) зазначено, що для неоад’ювантної терапії HR+/HER2- РГЗ пріоритетними залишаються схеми АС (доксорубіцин + циклофосфамід) + Т (таксани). Додавання олапарибу в ад’ювантному режимі протягом 1 року рекомендовано для пацієнтів з gBRCAm1/2 та HR+/HER2- пухлинами, якщо наявні:
- ≥4 позитивних лімфатичних вузлів після ад’ювантної ХТ (категорія 2А), або
- залишкова хвороба після неоад’ювантної терапії та клінічна стадія, патологічна стадія, статус естрогенових рецепторів і ступінь пухлини (CPS+EG) ≥3 балів (категорія 2А).
Згідно з результатами дослідження OlympiA, у пацієнтів з HR+/HER2- РГЗ додавання олапарибу в ад’ювантному режимі покращило 3-річну ВБОІЗ на 6,3% порівняно з плацебо (A. Tutt, 2022). А застосування рибоциклібу в аналогічній популяції хворих у дослідженні NATALEE забезпечило лише 3,3% переваги (D. Slamon, 2023). Отже, необхідно враховувати статус BRCA при виборі оптимальної ад’ювантної терапії РГЗ.
Відповідно до рекомендацій ESMO, послідовна схема на основі антрацикліну/таксану є стандартом лікування при ТНРГЗ (H.J. Burstein, 2021; F. Cardoso, 2019). Додавання препаратів платини та пембролізумабу до стандартної ХТ у пацієнтів з BRCA-асоційованим ТНРГЗ є дискусійним питанням. Відомо, що у звичайних хворих на ТНРГЗ використання комбінацій із вмістом похідних платини та пембролізумабу в неоад’ювантному режимі покращує патоморфологічну відповідь (pCR) та знижує ризик рецидивування. Однак віддалені результати залишаються невідомими. Враховуючі суперечливі дані, наразі рутинне використання препаратів платини як частини неоад’ювантної терапії ТНРГЗ не рекомендоване для більшості пацієнтів (включаючи носіїв BRCA-мутацій), але може бути розглянуте у хворих, для яких необхідне отримання кращого локального контролю (NCCN, 2023).
Отже, питання неоад’ювантної терапії BRCA-асоційованого ТНРГЗ на сьогодні є предметом активних дискусій. І хоча сучасні дані демонструють, що стандартні режими терапії ефективні при звичайному ТНРГЗ, у популяції пацієнтів з BRCA-мутаціями ці схеми можуть виявитися неоптимальними. Зокрема, одним з найбільш обговорюваних моментів є доцільність додавання пембролізумабу. Хоча він разом з карбоплатином покращував pCR у дослідженні KEYNOTE-522, не було проведено окремого аналізу ефективності цієї комбінації в учасників з мутаціями BRCA. Тож наразі недостатньо даних щодо доцільності використання пембролізумабу саме у носіїв BRCA-мутацій (P. Schmid, 2020). На противагу цьому, відповідно до останнього оновлення настанов NCCN (2023) щодо менеджменту пацієнтів з РГЗ, рекомендовано розглянути можливість додавання олапарибу в ад’ювантну терапію протягом 1 року для пацієнтів із gBRCAm1/2 та ТНРГЗ, якщо:
- захворювання ≥рТ2 або ≥рN1 після ад’ювантної ХТ, або
- залишкова хвороба після неоад’ювантної ХТ.
Дослідження OlympiA та KEYNOTE-522 запропонували альтернативні стратегії лікування хворих на ТНРГЗ, демонструючи ефективність різних підходів залежно від молекулярно-генетичних характеристик пухлини. В OlympiA після завершення стандартної ХТ усім пацієнтам з gBRCAm призначали PARP-інгібітор олапариб, що значно знижувало ризик прогресування захворювання. Натомість у КЕYNOTE-522 досліджувалась ефективність додавання хіміопрепарату карбоплатину й імунотерапевтичного засобу пембролізумабу до стандартної ХТ. Однак статус мутацій BRCA при цьому не враховувався.
Порівнюючи результати досліджень OlympiA та KEYNOTE-522, у яких вивчали альтернативні стратегії лікування хворих на ТНРГЗ, можна зробити низку важливих висновків. Зокрема, у пацієнтів з ТНРГЗ без рCR в дослідженні OlympiA застосування олапарибу асоціювалося з 3-річною ВБОІЗ на рівні 81,4%, що на 13,7% перевищувало такий показник у групі плацебо (67,7%). Натомість застосування пембролізумабу в схожій популяції пацієнтів дослідження KEYNOTE-522 забезпечило 3-річну виживаність без подій 67,4%, що лише на 10,6% перевищувала таку у контрольній групі (56,8%). Варто зазначити, що 67,7% 3-річна ВБОІЗ у групі плацебо дослідження OlympiA була досягнута після проведення первинного лікування із застосуванням стандартної ХТ (антрацикліни + таксани) у 73% випадків, що практично збігається з ефективністю пембролізумабу у KEYNOTE-522. Водночас схема лікування з пембролізумабом асоціювалася зі значно вищою токсичністю, через що частина пацієнтів була вимушена передчасно припинити терапію. Ще однією перевагою стратегії OlympiA для пацієнтів з позитивним статусом BRCAm є те, що саме застосування олапарибу протягом 1 року як наступної ад’ювантної терапії продемонструвало статистично значуще покращення ЗВ у пацієнтів з ТНРГЗ порівняно з плацебо, в той час як у дослідженні KEYNOTE-522 не було досягнуто статистичної та клінічної переваги щодо ЗВ в групі пембролізумабу проти групи плацебо.
Отже, проведений аналіз свідчить, що оптимальна стратегія лікування BRCA-асоційованого ТНРГЗ має ґрунтуватися на даних дослідження OlympiA, а саме: проведення стандартної неоад’ювантної ХТ без додавання препаратів платини, оскільки саме для пацієнтів з BRCA-позитивним статусом вони не підвищують ефективність лікування, та післяопераційне призначення олапарибу, адже саме цей PARP-інгібітор продемонстрував найкращі результати у зазначеної категорії хворих. Використання режимів на основі платини та пембролізумабу має обмежуватись окремими випадками за медичними показаннями. Натомість за відсутності BRCA-мутацій поєднання ХТ препаратами платини та імунотерапії є виправданою опцією для пацієнтів з ТНРГЗ ІІ-ІІІ стадій.
 Анна Василівна Хмель, клінічний онколог, провідний онколог клініки «Спеціалізований мамологічний центр» (м. Київ) поділилася власним клінічним досвідом успішного лікування молодої пацієнтки з BRCA1-асоційованим РГЗ шляхом призначення олапарибу в ад’ювантному режимі.
Анна Василівна Хмель, клінічний онколог, провідний онколог клініки «Спеціалізований мамологічний центр» (м. Київ) поділилася власним клінічним досвідом успішного лікування молодої пацієнтки з BRCA1-асоційованим РГЗ шляхом призначення олапарибу в ад’ювантному режимі.
Клінічний випадок
Пацієнтка, 1987 р.н. У листопаді 2021 року самостійно виявила новоутворення у правій грудній залозі.
Листопад 2021 р., ультразвукове дослідження грудної залози: на 10-й годині в зоні С – новоутворення низької ехогенності з нечітким, нерівним контуром, 9,1×8,4×5,5 мм, з ознаками неоваскуляризації. Двічі проведено трепанобіопсію новоутворення правої грудної залози без виявлення злоякісних клітин. Проведена секторальна резекція правої грудної залози з експрес-діагностикою.
Попередній діагноз: протокова інвазивна карцинома. Проведено дисекцію аксилярних лімфатичних вузлів. Розмір пухлини 0,9 мм. Видалено 11 лімфатичних вузлів, у 4 із них – ознаки метастазів карциноми.
Післяопераційне гістологічне та імуногістохімічне дослідження: протокова карцинома Es-, Pr-, Ki-67 – 70%, HER2/neu-.
Листопад 2021 р., магнітно-резонансна томографія головного мозку: метастази не виявлено. Відповідно до результатів комп’ютерної томографії (КТ) з контрастуванням органів грудної клітки, черевної порожнини та малого таза, вторинного ураження не виявлено.
У грудні 2021 р. проведено молекулярно-генетичне дослідження методом NGS (кров): виявлено мутацію BRCA1.
Перегляд блоків: низькодиференційована інвазивна карцинома Es-,Pr-, Ki-67 – 30-50%, HER2/neu +2. FISH-ампліфікація не виявлена.
Пройшла курс ад’ювантної ХТ за схемою: 4 АС (доксорубіцин 60 мг/м2 площі поверхні тіла + циклофосфамід 600 мг/м2) 1 раз на 14 днів + 12 введень паклітакселу 80 мг/м2, без додавання карбоплатину. Курс променевої терапії не отримала в зв’язку зі складнощами в країні під час військового стану.
У червні 2022 р. проведене оперативне лікування: двобічна мастектомія з одномоментною реконструкцією; ознак карциноми не виявлено.
Враховуючи вік хворої, агресивність карциноми, наявність мутації BRCA1, ураження лімфатичних вузлів, порушення протоколу лікування, призначено олапариб у дозі 600 мг на добу на 1 рік (червень 2022 – липень 2023 р.). Побічні прояви спостерігались у перші 3 місяці: нудота, запаморочення, слабкість, анемія легкого ступеня. Корекція дози не проводилась.
У липні 2023 р. за даними магнітно-резонансної томографії грудних залоз виявлено ознаки капсулярної контрактури правої грудної залози як ускладнення післяопераційної гематоми.
У серпні 2023 р. відповідно до результатів КТ з контрастуванням органів грудної клітки, черевної порожнини та малого таза – стан після лікування з приводу РГЗ. Ознак хвороби не виявлено.
Таким чином, наведений клінічний випадок демонструє важливість визначення статусу BRCA-мутацій для оптимізації лікування хворих на РГЗ. Завдяки своєчасному тестуванню та виявленню генетичного дефекту BRCA1 вдалося пояснити агресивний перебіг захворювання у молодої жінки й обрати адекватну персоналізовану стратегію лікування. Зокрема, призначення олапарибу цільовим чином вплинуло на генетичні механізми канцерогенезу, що дозволило контролювати хворобу та запобігти її прогресуванню.
Підготувала Анна Сочнєва
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 5 (84) 2023 р.



