18 квітня, 2025
Уродинамічні дослідження у хворих на доброякісну гіперплазію передміхурової залози
 У статті описано уродинамічні дослідження, які виконують у пацієнтів із доброякісною гіперплазією передміхурової залози (ДГПЗ) із метою визначення в них обструктивного сечовипускання, функціонального стану детрузора та виключення нейрогенної дисфункції нижніх сечових шляхів (НДНСШ). Ці методи дозволяють встановити стадію ДГПЗ й обрати відповідний вид лікування пацієнта.
У статті описано уродинамічні дослідження, які виконують у пацієнтів із доброякісною гіперплазією передміхурової залози (ДГПЗ) із метою визначення в них обструктивного сечовипускання, функціонального стану детрузора та виключення нейрогенної дисфункції нижніх сечових шляхів (НДНСШ). Ці методи дозволяють встановити стадію ДГПЗ й обрати відповідний вид лікування пацієнта.
Ключові слова: уродинамічні дослідження, доброякісна гіперплазія передміхурової залози, симптоми нижніх сечових шляхів, нейрогенна дисфункція нижніх сечових шляхів, гіперактивний сечовий міхур, урофлоуметрія, визначення залишкової сечі, цистометрія.
Термін уродинамічні дослідження (УД) був уперше запропонований у 1953 році американським урологом D.M. Davis, який займався вивченням фаз наповнення та спорожнення сечового міхура [13, 14]. Термін «urodynamic studies» був визначений Міжнародним товариством з утримання сечі (ICS) 1988 року «як оцінювання функції чи дисфункції нижніх сечових шляхів відповідним методом» [16]. УД дозволяють встановити функціональний стан сечового міхура та сфінктерного апарату уретри за допомогою вимірювання відповідних фізіологічних параметрів. УД мають велике значення у хворих на ДГПЗ при обструкції шийки сечового міхура гіперплазованими вузлами простати. Виявлення ступеня обструктивного сечовипускання за допомогою УД дає можливість урологу вибрати відповідний метод лікування – консервативний чи хірургічний. Крім того, УД дозволяють встановити функціональний стан детрузора (гіперактивний, гіпоактивний, аконтрактильний сечовий міхур), що також впливає на вибір тактики лікування.
Урологи користуються тристадійною класифікацією ДГПЗ за F. Guyon (1881), яка базується на функціональному стані сечового міхура [3, 8, 13]:
- І стадія ДГПЗ – компенсації – характеризується відсутністю залишкової сечі після сечовипускання (<50 мл);
- ІІ стадія – субкомпенсації – відзначається наявністю залишкової сечі після сечовипускання >50 мл;
- ІІІ стадія – декомпенсації – характеризується гіпоконтрактильністю детрузора, парадоксальною затримкою сечі (ішурією), розширенням верхніх сечових шляхів та хронічною нирковою недостатністю (ХНН).
ICS (2023) [24] та Європейська асоціація урології (EAU, 2024) [19, 20] дають наступні визначення обструкції шийки сечового міхура та порушенням функції детрузора.
Обструкція шийки сечового міхура (інфравезикальна обструкція) – загальний термін обструктивного сечовипускання, який характеризується підвищенням детрузоргого тиску (Pdet) та зменшенням потоку сечі (flow rate). Визначають при цистометрії спорожнення.
Гіпоконтрактильність детрузора (гіпоактивність детрузора) – зменшення сили скорочення детрузора та його тривалості, які призводять до тривалого скорочення сечового міхура й/або неможливості повністю спорожнити сечовий міхур протягом звичного часу сечовипускання. Визначають при цистометрії спорожнення.
Аконтрактильність детрузора – відсутність скорочень детрузора при УД.
Гіперактивність детрузора – характеризується мимовільними скороченнями детрузова у фазу наповнення сечового міхура, які можуть бути спонтанними або спровокованими. Гіперактивність детрузора зазвичай асоціюється із синдромом гіперактивного сечового міхура (ГАСМ). За наявності неврологічного захворювання гіперактивність детрузора називають нейрогенною, за відсутності — ідіопатичною. Визначають при цистометрії наповнення.
УД мають ключове значення в обстеженні хворих із НДНСШ, оскільки дозволяють визначити не лише функціональний стан сечового міхура та сфінктерного апарату уретри, а й їхню дисфункцію – детрузорно-сфінктерну диссинергію (ДСД) [7, 18, 25, 30-32]. НДНСШ є дисфункцією нижніх сечових шляхів, які виникають у результаті підтвердженого порушення іннервації. У разі ДСД спорожнення сечового міхура (скорочення детрузора) виникає одночасно з мимовільними скороченнями посмугованих м’язів уретри й/або парауретральних (промежинних) м’язів. ДСД призводить до підвищення тиску в сечовому міхурі, міхурово-сечовідних (мискових) рефлюксів сечі, розширення верхніх сечових шляхів і ниркової недостатності. НДНСШ зустрічаються у 1,6% чоловіків віком від 15 до 64 років, можуть мати місце й у хворих на ДГПЗ.
НДНСШ мають подібну до ДГПЗ клінічну картину, тому в пацієнтів цієї категорії хірургічні втручання з приводу ДГПЗ можуть бути неефективними [13]. Нейрогенна гіперактивність детрузора виникає при інсульті, хворобі Паркінсона, пухлинах та травмах спинного мозку, розсіяному склерозі, деменції. Нейрогенна гіпоконтрактильність детрузора (гіпоактивність детрузора) має місце при цукровому діабеті (діабетична цистопатія), операціях на органах таза, після променевої терапії, при ураженнях сакрального відділу спинного мозку (розсіяний склероз, спинномозкова грижа, стеноз каналу хребців, порушення спинномозкового кровообігу та ін.). З цих причин при опитуванні та огляді хворого на ДГПЗ необхідно встановити або виключити зазначені патології, направити на консультацію до невропатолога. Необхідно пам’ятати, що симптоми ДГПЗ (симптоми нижніх сечових шляхів – СНСШ) зумовлені порушенням накопичувальної (резервуарної) та спорожнюючої (евакуаторної) функцій сечового міхура і можуть зустрічатися у хворих з іншою інфравезикальною обструкцією (стриктури уретри, рак передміхурової залози, стороннє тіло сечового міхура та ін.), при інфекційних процесах у нижніх сечових шляхах та передміхуровій залозі, пухлинах сечового міхура, камені в дистальному відділі сечоводу та ін. [9, 19, 26-28]. Ця патологія також має бути виключена урологом.
У 2012 році у м. Фукуока (Японія) відбулась Міжнародна консультація з приводу СНСШ у чоловіків із публікацією матеріалів у 2013 році [28]. Автори розділили тести діагностики СНСШ на ґрунті ДГПЗ у чоловіків на основні та спеціалізовані, рекомендовані та необов’язкові (рис. 1, 2). До рекомендованих тестів відносять урофлоуметрію (УФМ), визначення кількості залишкової сечі та дослідження «тиск/потік».
![Рис. 1. Основні та спеціалізовані тести діагностики СНСШ на фоні ДГПЗ [28] Рис. 1. Основні та спеціалізовані тести діагностики СНСШ на фоні ДГПЗ [28]](/multimedia/userfiles/images/2025/Uro_1_2025/Uro_1_2025_st22_pic1.webp) Рис. 1. Основні та спеціалізовані тести діагностики СНСШ на фоні ДГПЗ [28]
Рис. 1. Основні та спеціалізовані тести діагностики СНСШ на фоні ДГПЗ [28]
 Рис. 2. Вимірювання залишкової сечі за допомогою портативного ультразвукового апарату (а) та абдомінального ультразвукового датчика (б)
Рис. 2. Вимірювання залишкової сечі за допомогою портативного ультразвукового апарату (а) та абдомінального ультразвукового датчика (б)
Згідно з рекомендаціями EAU (2024) [19], УД застосовують перед хірургічним втручанням у наступних випадках:
- вік чоловіка <50 років або >80 років;
- наявність залишкової сечі >300 мл;
- максимальна об’ємна швидкість потоку сечі (Qmax) >15 мл/с;
- неврологічні захворювання в анамнезі;
- перенесені радикальні втручання на органах таза;
- попереднє безуспішне інвазивне втручання на нижніх сечових шляхах;
- пацієнти із двобічним гідронефрозом;
- об’єм сечі при однократному сечовипусканні становить ≤150 мл.
У хворих на ДГПЗ планово виконують вимірювання залишкової сечі при абдомінальній ультрасонографії сечового міхура, УФМ (визначення Qmax) та дослідження «тиск/потік» при цистометрії спорожнення. Перші два дослідження є неінвазивними. Експерти EAU (2024) [19] визначили два ступеня рекомендацій щодо УФМ у діагностиці ДГПЗ: слабкий – для початкового обстеження хворого із СНСШ та сильний – перед медикаментозним або інвазивним лікуванням.
У пацієнтів із симптомами ГАСМ виконують цистометрію наповнення для виявлення гіперактивності детрузора, у нейроурологічних хворих із СНСШ – комплексне (багатоканальне) уродинамічне, а краще – відеоуродинамічне дослідження [7, 15, 20, 24, 30-32].
УФМ (uron [грец.] – сеча; flow [англ.] – потік, струмінь; metreo [грец.] – вимірювати) – метод неінвазивного дослідження уродинаміки, який полягає у прямій графічній реєстрації об’ємної швидкості потоку сечі під час сечовипускання, що сумарно відображає функціональний стан детрузора (тонус, скоротлива здатність) та прохідність (резистентність) уретри [5, 6, 10-12, 14, 26]. УФМ об’єктивно оцінює акт сечовипускання та орієнтовно – резервуарну й евакуаторну функції сечового міхура. За допомогою УФМ графічно реєструють кількість виділеної сечі за одиницю часу [11]. УФМ – неінвазивне, просте, інформативне, легко документоване моніторингове скринінгове дослідження, яке не вимагає матеріальних, фізичних та часових затрат і може бути корисним для медико-соціальної експертизи [12]. До 60% італійських амбулаторних урологів використовують УФМ у своїй рутинній практиці [12]. УФМ уперше була запропонована E. Rehfish (1897), перша серйозна клінічна робота із застосуванням цього дослідження виконана W.M. Drake (1948), а перший електронний урофлоуметр був сконструйований B. Von Garrelts (1956) [11, 12].
Сечовипускання складається з комбінації скорочення сечового міхура та розслаблення шийки міхура й уретри, що забезпечує швидке та повне спорожнення міхура. Швидкість потоку сечі визначається тиском детрузора та опором уретри. УФМ – єдиний неінвазивний уродинамічний метод визначення активності детрузора та опору уретри у фазу спорожнення сечового міхура, а тому є цінним скринінговим інструментом для оцінки прохідності (пропускної здатності) нижніх сечових шляхів, особливо у хворих на ДГПЗ.
Дія сучасних урофлоуметрів заснована на різних фізичних принципах: ваговому, ємнісному або ротаційному перетворюючому потоку сечі. В Україні налагоджено випуск сертифікованого вітчизняного урофлоуметра «Потік-К» (м. Дніпро), який застосовують у багатьох клініках [4, 5]. Урофлоуметр складається з воронки, по якій сеча надходить у накопичувальний резервуар, та перетворювача (рис. 3, 4). Дослідження виконують у момент звичного позиву до сечовипускання, в окремій кімнаті й за відсутності медперсоналу.
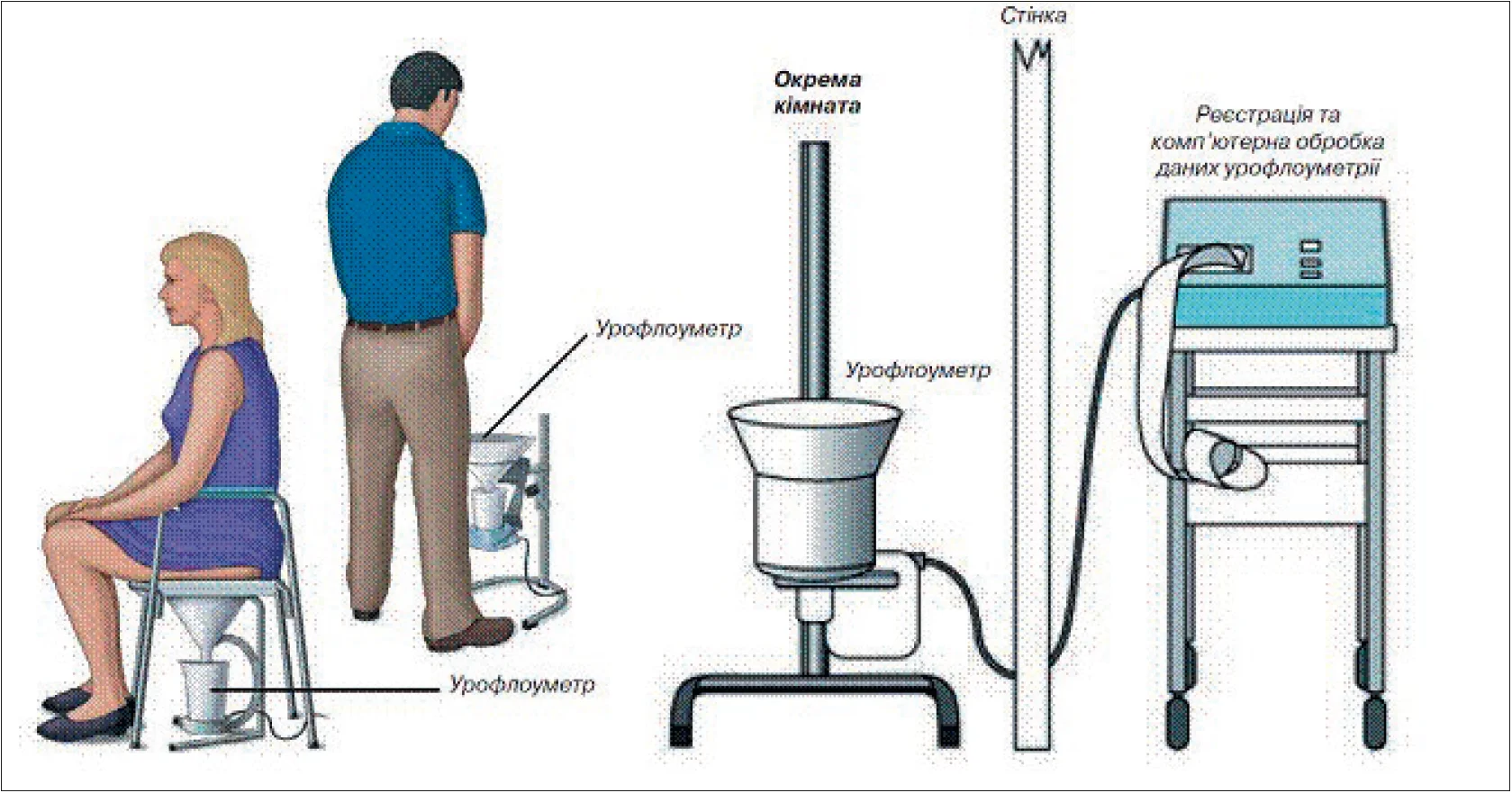 Рис. 3. Проведення УФМ у жінок та чоловіків
Рис. 3. Проведення УФМ у жінок та чоловіків
Рис. 4. Урофлоуметр «Потік-К» з оснащенням та програмним забезпеченням
При УФМ оцінюють наступні параметри (рис. 5):
- Qmax – максимальне виділення сечі за одиницю часу;
- час сечовипускання (Tvoid) – проміжок часу, протягом якого відбувається сечовипускання (без урахування проміжків його переривання);
- час досягнення максимального потоку сечі (ТQmax) – проміжок часу від початку сечовипускання до досягнення максимальної об’ємної швидкості потоку сечі;
- середня об’ємна швидкість потоку сечі (Qave) – середнє значення об’ємної швидкості потоку сечі або відношення об’єму виділеної сечі до часу сечовипускання;
- об’єм сечовипускання (Vura) – об’єм сечі (без урахування залишкової), виділеної під час сечовипускання;
- характер кривої урофлоуметрограми.
![Рис. 5. Нормальний («дзвоникоподібний») вигляд урофлоуметричної кривої та її параметри [13] Рис. 5. Нормальний («дзвоникоподібний») вигляд урофлоуметричної кривої та її параметри [13]](/multimedia/userfiles/images/2025/Uro_1_2025/Uro_1_2025_st22_pic5.webp) Рис. 5. Нормальний («дзвоникоподібний») вигляд урофлоуметричної кривої та її параметри [13]
Рис. 5. Нормальний («дзвоникоподібний») вигляд урофлоуметричної кривої та її параметри [13]
У чоловіків нормальним вважають сечовипускання об’ємом ≥150 мл із Qmax ≥15 мл/c, при цьому урофлоуметрична крива має «дзвоникоподібний» вигляд. Інфравезикальну обструкцію у чоловіків виявляють у 70-90% випадків при Qmax <10 мл/c, сумнівним вважається результат при Qmax >10 мл/c, але <15 мл/c [4, 5, 11, 12, 21, 23].
Більшість урологів вважають, що УФМ має виконуватись у кожному урологічному кабінеті для оцінки ефективності різних методів лікування ДГПЗ. Зниження Qmax у пацієнта за наявності великої кількості залишкової сечі свідчить про обструкцію шийки сечового міхура, як правило, у результаті ДГПЗ (рис. 6). Зниження Qmax за відсутності значної кількості залишкової сечі вказує на зниження скоротливої здатності (контрактильності) детрузора, що має місце при його нейрогенному ураженні, цукровому діабеті та ін.
![Рис. 6. Урофлоуметрична крива в нормі та за наявності ДГПЗ [3, 13] Рис. 6. Урофлоуметрична крива в нормі та за наявності ДГПЗ [3, 13]](/multimedia/userfiles/images/2025/Uro_1_2025/Uro_1_2025_st22_pic6.webp) Рис. 6. Урофлоуметрична крива в нормі та за наявності ДГПЗ [3, 13]
Рис. 6. Урофлоуметрична крива в нормі та за наявності ДГПЗ [3, 13]
УФМ дає змогу оцінити інтенсивність потоку сечі, не даючи чіткої відповіді на головне запитання: зменшення пропускної здатності уретри пов’язане зі зменшенням просвіту (обструкцією) уретри чи пригніченням скоротливої здатності м’яза, що виштовхує сечу (детрузора). У таких випадках застосовують інвазивне УД – цистометрію спорожнення, при якій досліджують детрузорний тиск (Рdet) під час сечовипускання та швидкість потоку сечі (Flow та його основний показник Qmax) (дослідження «тиск/потік» при цистометрії спорожнення) (рис. 7, 8).
![Рис. 7. Дослідження «тиск/потік» при цистометрії спорожнення в нормі: потік сечі високий (Qmax~20 мл/с) за низького Рdet (~20 см вод. ст.) [28]. Зеленим колом позначено Рdet при Qmax Uro_1_20Рис. 7. Дослідження «тиск/потік» при цистометрії спорожнення в нормі: потік сечі високий (Qmax~20 мл/с) за низького Рdet (~20 см вод. ст.) [28]. Зеленим колом позначено Рdet при Qmax25_st22_pic7.webp](/multimedia/userfiles/images/2025/Uro_1_2025/Uro_1_2025_st22_pic7.webp) Рис. 7. Дослідження «тиск/потік» при цистометрії спорожнення в нормі: потік сечі високий (Qmax~20 мл/с) за низького Рdet (~20 см вод. ст.) [28]. Зеленим колом позначено Рdet при Qmax
Рис. 7. Дослідження «тиск/потік» при цистометрії спорожнення в нормі: потік сечі високий (Qmax~20 мл/с) за низького Рdet (~20 см вод. ст.) [28]. Зеленим колом позначено Рdet при Qmax
Рис. 8. Дослідження «тиск/потік» при цистометрії спорожнення в пацієнта із ДГПЗ та обструктивним сечовипусканням: потік сечі низький (Qmax~4 мл/с) за високого Рdet (~100 см вод. ст.) [28]. Червоним колом позначено Рdet при Qmax
Цистометрія (цистометрографія, CMG) – дослідження співвідношення тиску/об’єму сечового міхура при наповненні, за допомогою якого визначають його активність, еластичність, чутливість та ємність. Зміни внутрішньоміхурового тиску у фазу наповнення та спорожнення сечового міхура відстежують за графіком одноканальної цистометрії (рис. 9). Здорова людина відчуває перше відчуття наповнення сечового міхура (FS – перше відчуття) при введенні 90-150 мл розчину; перший позив до сечовипускання (FD – перше бажання), при якому можливо відстрочити сечовипускання – при введенні 200-400 мл розчину; сильний позив (SD) – нестримний, який неможливо відстрочити – при введенні 400-600 мл розчину [7, 14, 26]. У нормі внутрішньоміхуровий тиск не перевищує 10-12 см вод. ст.; сечовипускання в нормі виникає при тиску ≤30-40 см вод. ст.; біль при наповненні сечового міхура та при сечовипусканні відсутній.
![Рис. 9. Цистометрограма в нормі (а), фазова (б) і термінальна (в) гіперактивність детрузора при виконанні одноканальної цистометрії [14] Рис. 9. Цистометрограма в нормі (а), фазова (б) і термінальна (в) гіперактивність детрузора при виконанні одноканальної цистометрії [14]](/multimedia/userfiles/images/2025/Uro_1_2025/Uro_1_2025_st22_pic9.webp) Рис. 9. Цистометрограма в нормі (а), фазова (б) і термінальна (в) гіперактивність детрузора при виконанні одноканальної цистометрії [14]
Рис. 9. Цистометрограма в нормі (а), фазова (б) і термінальна (в) гіперактивність детрузора при виконанні одноканальної цистометрії [14]
Цистометрія наповнення є найбільш важливим уродинамічним тестом, який визначає гіперактивність детрузора (при цьому наповнення сечового міхура проводять із постійною швидкістю – зазвичай 40-60 мл/хв). Якщо у хворого із симптомами ГАСМ (ургентність, полакіурія, ноктурія, імперативне нетримання сечі) при цистометрії наповнення не виявляють гіперактивності детрузора, то такий стан розцінюють як ГАСМ без гіперактивності детрузора. Якщо в такого пацієнта при цистометрії наповнення діагностують підвищену чутливість детрузора (зниження показників FS, FD і SD), то такий сечовий міхур називають гіперчутливим [7].
Розрізняють одно- та багатоканальну цистометрію. При одноканальній цистометрії (рис. 10) у сечовий міхур через уретру вводять катетер для наповнення міхура і поряд встановлюють катетер із датчиком для вимірювання внутрішньоміхурового тиску (Рves). Сучасні одноканальні уродинамічні системи передбачають введення в сечовий міхур лише одного катетера з датчиком, за допомогою якого одночасно наповнюють міхур стерильним розчином і вимірюють Рves. Недоліком цистометрії є неможливість вимірювання Рdet. Тиск у міхурі складається із суми двох тисків: Рves = Рdet + Pabd (де Pabd – навколоміхуровий тиск, або тиск у черевній порожнині). Рdet складається з пасивних та активних сил стінки міхура. Пасивні сили утворені еластичністю тканин стінки, активні – скороченням м’язових волокон детрузора та їхнім тонусом. Тому при одноканальній цистометрії складно встановити причину підвищення Рves: через підвищення Рdet (спонтанні підвищення Рdet мають місце при ГАСМ) або ж через підвищення Pabd. Показники Рves і Рdet є однаковими у тому випадку, коли Pabd=0, тобто хворий при одноканальній цистометрії має знаходитися положенні лежачи за відсутності провокаційних проб (натужування, кашель). Останні ведуть до підвищення Pabd, а також можуть спровокувати підвищення Рdet, який неможливо виявити одноканальною цистометрією. Спонтанні підвищення Рves у фазу наповнення (фазові скорочення детрузора) і/або наприкінці наповнення сечового міхура (термінальні скорочення детрузора) за відсутності провокаційних проб при одноканальній цистометрії свідчать про гіперактивність детрузора (див. рис. 9).
![Рис. 10. Одноканальна цистометрія у чоловіка для вимірювання лише внутрішньоміхурового тиску (Рves) [14] Рис. 10. Одноканальна цистометрія у чоловіка для вимірювання лише внутрішньоміхурового тиску (Рves) [14]](/multimedia/userfiles/images/2025/Uro_1_2025/Uro_1_2025_st22_pic10.webp) Рис. 10. Одноканальна цистометрія у чоловіка для вимірювання лише внутрішньоміхурового тиску (Рves) [14]
Рис. 10. Одноканальна цистометрія у чоловіка для вимірювання лише внутрішньоміхурового тиску (Рves) [14]
Методом субтракційної цистометрії (рис. 11) одночасно вимірюють тиск у сечовому міхурі та черевній порожнині (другий катетер із датчиком розміщують у прямій кишці), при цьому уродинамічна система автоматично вимірює Рdet за різницею Рves та Pabd. Спонтанні підвищення Рdet у фазу наповнення сечового міхура й/або наприкінці наповнення свідчать про гіперактивність детрузора та ГАСМ у чоловіка (рис. 12).
![Рис. 11. Субтракційна цистометрія: вимірювання внутрішньоміхурового (Рves), внутрішньочеревного (Pabd) і детрузорного (Рdet) тиску за різницею Рves та Pabd [14] Рис. 11. Субтракційна цистометрія: вимірювання внутрішньоміхурового (Рves), внутрішньочеревного (Pabd) і детрузорного (Рdet) тиску за різницею Рves та Pabd [14]](/multimedia/userfiles/images/2025/Uro_1_2025/Uro_1_2025_st22_pic11.webp) Рис. 11. Субтракційна цистометрія: вимірювання внутрішньоміхурового (Рves), внутрішньочеревного (Pabd) і детрузорного (Рdet) тиску за різницею Рves та Pabd [14]
Рис. 11. Субтракційна цистометрія: вимірювання внутрішньоміхурового (Рves), внутрішньочеревного (Pabd) і детрузорного (Рdet) тиску за різницею Рves та Pabd [14]
![Рис. 12. Фазова гіперактивність детрузора (позначена стрілками) за даними субтракційної цистометрії у пацієнта з ГАСМ (підвищення Рves зумовлено мимовільними скороченнями детрузора у фазу наповнення сечового міхура) [7] Рис. 12. Фазова гіперактивність детрузора (позначена стрілками) за даними субтракційної цистометрії у пацієнта з ГАСМ (підвищення Рves зумовлено мимовільними скороченнями детрузора у фазу наповнення сечового міхура) [7]](/multimedia/userfiles/images/2025/Uro_1_2025/Uro_1_2025_st22_pic12.webp) Рис. 12. Фазова гіперактивність детрузора (позначена стрілками) за даними субтракційної цистометрії у пацієнта з ГАСМ (підвищення Рves зумовлено мимовільними скороченнями детрузора у фазу наповнення сечового міхура) [7]
Рис. 12. Фазова гіперактивність детрузора (позначена стрілками) за даними субтракційної цистометрії у пацієнта з ГАСМ (підвищення Рves зумовлено мимовільними скороченнями детрузора у фазу наповнення сечового міхура) [7]
Недоліком субтракційної цистометрії є неможливість одночасного вимірювання внутрішньоуретрального тиску (Рure), що важливо в діагностиці нетримання сечі на фоні ДСД у хворих із НДНСШ. У нормі підвищення Рves не призводить до нетримання сечі, оскільки Рure завжди перевищує Рves. При ДСД має місце зниження Рure з підвищенням Рves, що і проявляється нетриманням сечі. Крім того, у хворих із НДНСШ при сечовипусканні (із підвищенням Рves за рахунок Рdet) має місце підвищення Рure, що сприяє обструктивному сечовипусканню, підвищенню Рves, розвитку міхурово-сечовідних рефлюксів, проникненню інфекції в нирки, підвищенню внутрішньомискового тиску й, як наслідок, розвитку уретерогідронефрозу та ниркової недостатності.
Саме багатоканальне (комплексне) УД (рис. 13) дозволяє виміряти Рves, Pabd, Рdet і додатково Рure, затульний тиск уретри Рucp (визначають як різницю між Рure та Рves), а також виконати цистометрію спорожнення (дослідження «тиск/потік»), електроміографію (ЕМG) м’язів тазового дна та сфінктерного апарату уретри. Спеціальні датчики вимірюють одночасно тиск у сечовому міхурі, детрузорний (тиск у сечовому міхурі мінус тиск у прямій кишці), внутрішньочеревний (датчик розміщують у прямій кишці) та внутрішньоуретральний тиск.
![Рис. 13. Схема виконання комплексного (багатоканального) УД у чоловіків (а, б) [26]: визначення внутрішньоміхурового тиску (Рves); внутрішньочеревного тиску (Pabd); EMG — електроміографія м’язів тазового дна; Qura — потік сечі Рис. 13. Схема виконання комплексного (багатоканального) УД у чоловіків (а, б) [26]: визначення внутрішньоміхурового тиску (Рves); внутрішньочеревного тиску (Pabd); EMG — електроміографія м’язів тазового дна; Qura — потік сечі](/multimedia/userfiles/images/2025/Uro_1_2025/Uro_1_2025_st22_pic13.webp) Рис. 13. Схема виконання комплексного (багатоканального) УД у чоловіків (а, б) [26]: визначення внутрішньоміхурового тиску (Рves); внутрішньочеревного тиску (Pabd); EMG — електроміографія м’язів тазового дна; Qura — потік сечі
Рис. 13. Схема виконання комплексного (багатоканального) УД у чоловіків (а, б) [26]: визначення внутрішньоміхурового тиску (Рves); внутрішньочеревного тиску (Pabd); EMG — електроміографія м’язів тазового дна; Qura — потік сечі
При цистометрії спорожнення (дослідження «тиск/потік») пацієнт спорожнює сечовий міхур у положенні стоячи (жінки – сидячи), при цьому оцінюють параметри УФМ та одночасно тиск у міхурі (а також Рdet як різницю між Рves та Pabd) під час сечовипускання (рис. 14). Даний метод дозволяє виявити обструкцію уретри та шийки сечового міхура у хворих на ДГПЗ. У разі обструкції уретри та шийки сечового міхура відмічають низьку Qmax (<15 мл/с) при високому Рdet (>50 см вод. ст.); у разі зниження активності детрузора (нейрогенний гіпоактивний сечовий міхур, ураження сечового міхура при цукровому діабеті) – низьку Qmax та низький Рdet. Контрактильність, або скоротливу здатність, детрузора визначають за величиною детрузорного тиску (Рdet), який обчислюють за різницею Рves (датчик заводять через уретру в сечовий міхур) та Pabd (датчик заводять у пряму кишку). У пацієнтів із ДГПЗ зазвичай Рdet знаходиться в межах норми, а зниження Qmax зумовлено обструкцією уретри гіперплазованими вузлами простати. У хворих із нейрогенним гіпоактивним сечовим міхуром та СНСШ зниження Qmax зумовлено зниженням Рdet, що свідчить про ураження м’яза, який виштовхує сечу. За таких умов хірургічне втручання на простаті (трансуретральна резекція простати [ТУРП], простатектомія) не показане, оскільки операція не дасть можливості усунути СНСШ у хворого.
![Рис. 14. Багатоканальне УД у чоловіка із ДГПЗ та обструктивним сечовипусканням, яке включає дослідження «тиск/потік» при цистометрії спорожнення: має місце зниження Qmax <10 мл/с за даними УФМ (позначено червоною стрілкою) при збереженому Рdet (>50 мм вод. ст.) (позначено синьою стрілкою) [13] Рис. 14. Багатоканальне УД у чоловіка із ДГПЗ та обструктивним сечовипусканням, яке включає дослідження «тиск/потік» при цистометрії спорожнення: має місце зниження Qmax <10 мл/с за даними УФМ (позначено червоною стрілкою) при збереженому Рdet (>50 мм вод. ст.) (позначено синьою стрілкою) [13]](/multimedia/userfiles/images/2025/Uro_1_2025/Uro_1_2025_st22_pic14.webp) Рис. 14. Багатоканальне УД у чоловіка із ДГПЗ та обструктивним сечовипусканням, яке включає дослідження «тиск/потік» при цистометрії спорожнення: має місце зниження Qmax <10 мл/с за даними УФМ (позначено червоною стрілкою) при збереженому Рdet (>50 мм вод. ст.) (позначено синьою стрілкою) [13]
Рис. 14. Багатоканальне УД у чоловіка із ДГПЗ та обструктивним сечовипусканням, яке включає дослідження «тиск/потік» при цистометрії спорожнення: має місце зниження Qmax <10 мл/с за даними УФМ (позначено червоною стрілкою) при збереженому Рdet (>50 мм вод. ст.) (позначено синьою стрілкою) [13]
У пацієнтів із ДГПЗ ІІ-ІІІ стадії (іншою інфравезикальною обструкцією – склерозом простати, стриктурою уретри та шийки сечового міхура) та тривалою інфравезикальною обструкцією може мати місце зниження потоку сечі та Рdet (гіпоконтрактильність детрузора), і саме цей стан діагностують за даними багатоканального УД. Багатоканальне (комплексне) УД, яке включає дослідження «тиск/потік» при цистометрії спорожнення, показано пацієнтам віком <50 та >80 років, при об’ємі сечовипускання за даними УФМ <150 мл, об’ємі залишкової сечі >300 мл, підозрі на нейрогенну дисфункцію сечового міхура, неефективності попереднього втручання на простаті, а також при двобічному гідронефрозі.
Міжнародне товариство з вивчення утримання сечі (ІCS, 2023) [24], Міжнародна консультація з нетримання сечі (ICI, 2017) [7] та Європейська асоціація урології (ЕАU, 2024) [20] рекомендують у хворих із НДНСШ застосовувати багатоканальне відеоуродинамічне дослідження, яке дозволяє візуально встановити ДСД та інші анатомо-функціональні зміни сечового міхура (дивертикул, баштоподібний сечовий міхур та ін.) (рис. 15). За наявності НДНСШ ДСД проявляється скороченням детрузора при сечовипусканні та сфінктерного апарату уретри (а не розслабленням його), що призводить до підвищення тиску в сечовому міхурі, до міхурово-сечовідних рефлюксів, двобічного уретерогідронефрозу та розвитку ХНН (рис. 16). НДНСШ може мати місце у хворого на ДГПЗ, що вимагатиме проведення багатоканального відеоуродинамічного дослідження [17] (рис. 17).
![Рис. 15. Уродинамічна система для багатоканального уродинамічного та відеоуродинамічного дослідження, яке включає також дослідження «тиск/потік» при цистометрії спорожнення (а); схематичне зображення багатоканального відеоуродинамічного дослідження в чоловіка з цистометрією спорожнення, візуалізацією сечового міхура та його шийки (б) [7] Рис. 15. Уродинамічна система для багатоканального уродинамічного та відеоуродинамічного дослідження, яке включає також дослідження «тиск/потік» при цистометрії спорожнення (а); схематичне зображення багатоканального відеоуродинамічного дослідження в чоловіка з цистометрією спорожнення, візуалізацією сечового міхура та його шийки (б) [7]](/multimedia/userfiles/images/2025/Uro_1_2025/Uro_1_2025_st22_pic15.webp) Рис. 15. Уродинамічна система для багатоканального уродинамічного та відеоуродинамічного дослідження, яке включає також дослідження «тиск/потік» при цистометрії спорожнення (а); схематичне зображення багатоканального відеоуродинамічного дослідження в чоловіка з цистометрією спорожнення, візуалізацією сечового міхура та його шийки (б) [7]
Рис. 15. Уродинамічна система для багатоканального уродинамічного та відеоуродинамічного дослідження, яке включає також дослідження «тиск/потік» при цистометрії спорожнення (а); схематичне зображення багатоканального відеоуродинамічного дослідження в чоловіка з цистометрією спорожнення, візуалізацією сечового міхура та його шийки (б) [7]
Рис. 16. Схематичне зображення багатоканального відеоуродинамічного дослідження в чоловіка із НДНСШ: відмічається баштоподібний сечовий міхур та двобічні міхурово-сечовідні рефлюкси. Vinf — об’єм стерильної рідини, уведеної в сечовий міхур [26]
![Рис. 17. Багатоканальне відеоуродинамічне дослідження у хворого із ДГПЗ та СНСШ: має місце зниження Qmax<10 мл/c (див. Flow) і гіперактивність детрузора (Рdet~140 см вод. ст.). На мікційній цистограмі шийка сечового міхура закрита та припіднята за рахунок гіперплазованих вузлів простати [121] Рис. 17. Багатоканальне відеоуродинамічне дослідження у хворого із ДГПЗ та СНСШ: має місце зниження Qmax<10 мл/c (див. Flow) і гіперактивність детрузора (Рdet~140 см вод. ст.). На мікційній цистограмі шийка сечового міхура закрита та припіднята за рахунок гіперплазованих вузлів простати [121]](/multimedia/userfiles/images/2025/Uro_1_2025/Uro_1_2025_st22_pic17.webp) Рис. 17. Багатоканальне відеоуродинамічне дослідження у хворого із ДГПЗ та СНСШ: має місце зниження Qmax<10 мл/c (див. Flow) і гіперактивність детрузора (Рdet~140 см вод. ст.). На мікційній цистограмі шийка сечового міхура закрита та припіднята за рахунок гіперплазованих вузлів простати [121]
Рис. 17. Багатоканальне відеоуродинамічне дослідження у хворого із ДГПЗ та СНСШ: має місце зниження Qmax<10 мл/c (див. Flow) і гіперактивність детрузора (Рdet~140 см вод. ст.). На мікційній цистограмі шийка сечового міхура закрита та припіднята за рахунок гіперплазованих вузлів простати [121]
Для визначення обструктивного (у тому числі й при ДГПЗ) та необструктивного (при гіпоконтрактильності детрузора) сечовипускання використовують індекс обструкції шийки сечового міхура (ВООІ – bladder outlet obstruction index), який визначають як різницю між Рdet при максимальному потоку сечі (Qmax) та подвоєною Qmax (ВООІ = Рdet Qmax — 2 Qmax) (рис. 18) [3, 13, 15]. Якщо індекс ВООІ становить >40, визначають обструктивний тип сечовипускання; якщо ВООІ <20 – необструктивний. Індекс обструкції шийки сечового міхура від 20 до 40 має подвійне (сумнівне) значення. Для визначення тонусу (активності, контрактильності) детрузора застосовують індекс контрактильності детрузора (ВСІ – bladder contractility index), який обчислюють за формулою: ВСІ = Рdet Qmax + 5 Qmax. При ВСІ >150 встановлюють гіперактивність детрузора; при ВСІ 100-150 – нормальну контрактильність; при ВСІ <100 – гіпоконтрактильність.
Рис. 18. Номограма індексу обструкції шийки сечового міхура (ВООІ) (а) та індексу контрактильності детрузора (ВСІ) (б) [3, 13]
У практиці уролога дослідження «тиск/потік» при цистометрії спорожнення має велике значення для вибору методу дренування сечового міхура при черезміхуровій простатектомії: за об’єму залишкової сечі до операції >500 мл, низьких значень Qmax (<15 мл/c) та Рdet (<50 см вод. ст.) простатектомію потрібно закінчувати надлобковим дренуванням сечового міхура для профілактики ускладнень (запальних процесів у сечових органах, затримки сечі після простатектомії) через гіпоконтрактильність детрузора; при низькій Qmax (<15 мл/c) та нормальному Рdet (>50 см вод. ст.) простатектомію можливо закінчити зашиванням сечового міхура наглухо.
При залобковій та трансцервікальній простатектомії травма (розсічення) детрузора відсутня, а тому відновлення контрактильності після усунення обструкції (видалення гіперплазованих вузлів простати) відбувається швидше, ніж при черезміхуровій простатектомії. Хворого та родичів необхідно попередити (за об’єму залишковій сечі до операції >500 мл, низьких Qmax і Рdet) про можливу затримку сечі після операції та необхідність встановлення уретрального катетера Фолея на певний час (1-3 тижні). Купірування обструкції у таких хворих не усуває знижену контрактильність детрузора, а гіпоконтрактильність може мати місце у хворих на ДГПЗ ІІ стадії без порушення уродинаміки верхніх сечових шляхів та ХНН. За даними ЕАU (2024), близько 11-40% хворих із СНСШ на фоні ДГПЗ мають гіпоактивність детрузора [19].
Ще одне прикладне значення має багатоканальне УД у пацієнта із ДГПЗ – визначення ізометричного детрузорного тиску (Рiso) [26, 29], який обчислюють під час механічного стоп-тесту: при сечовипусканні (дослідження «тиск/потік» при цистометрії спорожнення) у середині акту перетискають статевий член для припинення сечовипускання та визначають максимальне значення Рdet у цей момент, що і є ізометричним детрузорним тиском (Рiso). Далі визначають детрузорний резерв за різницею між Рiso та РdetQmax. У разі детрузорного резерву <20 хворому необхідно пропонувати оперативне лікування (ТУРП або відкриту простатектомію); за Рiso >20 см вод. ст. та наявності у пацієнта супутніх захворювань і виникнення (у майбутньому) гострої затримки сечі – можливе проведення спроби сечовипускання після видалення уретрального катетера (спроба сечовипускання без катетера) у поєднанні з прийомом α-адреноблокатора у зв’язку зі збереженою контрактильністю детрузора. Необхідно пам’ятати, що будь-яке УД не може бути заміною виваженого рішення професійного уролога, але зможе змінити його у складних та сумнівних випадках [11].
Дослідження «тиск/потік» при цистометрії спорожнення є інвазивним УД із введенням у сечовий міхур уретрального катетера, а тому компанія SRS Medical у 2007 році запропонувала неінвазивне дослідження «тиск/потік» з використанням апарата UroCuff CT 3000 без уведення в сечовий міхур уретрального катетера (рис. 19-22) [26, 29]. За допомогою UroCuff CT 3000 проводять диференціальну діагностику між обструкцією шийки сечового міхура на фоні ДГПЗ та гіпоконтрактильністю детрузора. Це дає можливість більш чітко встановити причини СНСШ та відібрати хворих для хірургічного втручання. Для цього на статевий член накладають спеціальну манжету UroCuff, на промежину та передню стінку живота – електроди, які під’єднують до апарата. Пацієнта з наповненим сечовим міхуром просять мочитися, при цьому поступово наповнюють манжету повітрям, що призводить спочатку до зменшення, а потім до зупинки акту сечовипускання. Далі повітря з манжети випускають і просять пацієнта знову мочитися. Акт сечовипускання зупиняють декілька разів для запису результатів і спорожнення сечового міхура. За допомогою портативного УЗД-апарата визначають залишкову сечу. За допомогою спеціальних номограм визначають у хворого тип сечовипускання (обструктивний чи необструктивний) та показання до хірургічного втручання. У зв’язку з малоінвазивністю та інформативністю дослідження урологи в деяких країнах роблять спроби запровадити це обстеження як обов’язкове за наявності СНСШ у хворого на ДГПЗ.
Рис. 19. Дослідження «тиск/потік» за допомогою апарата UroCuff CT 3000 (SRS Medical)
 Рис. 20. Схема дослідження «тиск/потік» за допомогою апарата UroCuff CT 3000 (SRS Medical)
Рис. 20. Схема дослідження «тиск/потік» за допомогою апарата UroCuff CT 3000 (SRS Medical)
Рис. 21. Методика проведення UroCuff Test (а, б)
Рис. 22. Визначення обструктивного типу сечовипускання у хворого на ДГПЗ за допомогою UroCuff Test
Повертаючись до урофлоуметрії, слід зазначити, що це дослідження доцільно використовувати перед початком, у процесі та після проведення лікування з приводу ДГПЗ, а також до та після хірургічного втручання. Зокрема, ми використовуємо урофлоуметрію для оцінки ефективності ТУРП та різних видів простатектомії (рис. 23).
 Рис. 23. Урофлоуметрограма хворого до (а) та після (б) одномоментної трансцервікальної простатектомії, виконана за допомогою урофлоуметра «Потік-К». Показник Qmax підвищився із 6,8 мл/с (до операції) до 34,7 мл/с (після операції)
Рис. 23. Урофлоуметрограма хворого до (а) та після (б) одномоментної трансцервікальної простатектомії, виконана за допомогою урофлоуметра «Потік-К». Показник Qmax підвищився із 6,8 мл/с (до операції) до 34,7 мл/с (після операції)
У 2018 році Є.А. Квятковський та Т.О. Квятковська видали інформаційний листок «Спосіб прогнозування очікуваного результату лікування доброякісної гіперплазії передміхурової залози α-адреноблокатором силодозином», у якому рекомендували проводити у хворих на ДГПЗ урофлоуметричне дослідження (із визначенням максимальної та середньої об’ємної швидкостей потоку сечі) до та після (через 2,5-3 год) прийому 8 мг силодозину [13]. За умови підвищення максимальної та середньої об’ємної швидкості потоку сечі на 25-30% хворим на ДГПЗ призначають тривалу медикаментозну терапію, за відсутності або незначного (до 25-30%) підвищення цих показників – проводять додаткове обстеження, після чого призначають препарати іншої групи або хірургічне лікування. Автори також провели УД у пацієнтів із ДГПЗ і встановили в них відсутність паралелізму між об’ємом простати, об’ємом залишкової сечі та показниками УФМ.
Сінгапурська урологічна асоціація (SUA, 2017) [17] представила оригінальну чотиристадійну класифікацію ДГПЗ, яка базується на трьох основних показниках обструктивних СНСШ: індекс якості життя за Міжнародною шкалою оцінки простатичних симптомів (IPSS-QоL), об’єм залишкової сечі та Qmax (рис. 24, таблиця). Ця класифікація дозволяє вибрати вид лікування в конкретного хворого (спостереження, медикаментозне або хірургічне лікування).
|
Таблиця. Класифікація ДГПЗ (SUA, 2017) [17] |
|||
|
Стадія |
Значна обструкція |
Докучливі симптоми |
Лікування |
|
І |
Відсутня |
Відсутні |
Спостереження та консультація |
|
ІІ |
Відсутня |
Наявні |
Медикаментозна терапія |
|
ІІІ |
Наявна |
Відсутні, наявні |
Хірургічні опції |
|
IV |
Ускладнення ДГПЗ |
Ускладнення ДГПЗ |
Хірургія |
Таким чином, УД у хворих на ДГПЗ мають важливе значення в практиці уролога, оскільки дозволяють встановити в них обструктивне сечовипускання та функціональний стан детрузора, а також виключити НДНСШ. Ці дослідження дозволяють обрати вид лікування (консервативний, хірургічний) та уникнути оперативного втручання при супутній НДНСШ.
Література
- Барало І.В. Порівняння показників урофлоуметрії у хворих із доброякісною гіперплазією передміхурової залози при хірургічному лікуванні залобковим та черезміхуровим доступом // Клінічна онкологія (спец. випуск). – 2015. – № 1. – С. 40-43.
- Горовий В.І. Патофізіологія та класифікація нейрогенних дисфункцій нижніх сечових шляхів // Здоров’я України. – 2023. – Тематичний номер № 3 (30). – С. 12-18.
- Залобкова простатектомія в хірургічному лікуванні доброякісної гіперплазії простати посібник / За ред. В.І. Горового, В.О. Шапринського, І.В. Барало та ін. – Вінниця: ТОВ «Твори», 2021. – 336 с.
- Квятковский АЕ., Квятковский Е.А., Квятковская Т.А. Первый опыт отечественного урофлоуметра для определения нарушений уродинамики нижних мочевых путей // Здоровье мужчины. – 2009. – № 3. – С. 157-158.
- Квятковская Т.А., Квятковский А.Е., Квятковский Е.А. Значение параметров урофлоуметрии при обследовании больных с доброкачественной гиперплазией предстательной железы в различных возрастных группах // Урологія. – 2012. – № 1. – С. 34-41.
- Ліваковський С.К., Морару-Бурлеску Р.П., Балацький О.Р., Довгань, І.І., Меташоп О.С. Оцінка акту сечовипускання після різних видів простатектомій у хворих на доброякісну гіперплазію простати. Науково-практична конференція молодих вчених з міжнародною участю «Молодіжна наука – 24». – Вінниця, 2024. – С. 37-38.
- Нейроурологія / За ред. В.І. Горового, В.О. Шапринського, О.І. Яцини, О.М. Капшука. – Вінниця: ТОВ «Твори», 2023. – 520 с.
- Пасєчніков С.П. Принципи класифікації, діагностики та лікування доброякісної гіперплазії передміхурової залози // Медичні аспекти здоров’я чоловіка. – 2018. – № 1 (28). – С. 36-41.
- Переверзев А.С., Козлюк В.А. Симптомы нижних мочевых путей. – Харьков: Факт, 2009. – 431 с.
- Пивоваров П.І., Головенко В.П., Барало І.В., Горовий В.І. Перший досвід розпізнавання гіперактивного сечового міхура у жінок за допомогою вітчизняного урофлоуметра UROWIN 01 // Актуальні питання медицини. – Вінниця: Консоль, 2007. – С. 119-121.
- Урофлоуметрия / Вишневский Е.Л. и др. – М.: Печатный город, 2004. – 220 с.
- Урофлоуметрия / Квятковская Т.А. и др. – Днепр: Лира, 2019. – 276 с.
- Хірургічне лікування доброякісної гіперплазії простати великих розмірів: черезміхурова простатектомія (відкрита, лапароскопічна, робот-асистована) / За ред. В.І. Горового та співавт. – Вінниця: ТОВ «Твори», 2023. – 380 с.
- Abrams P. Urodynamics. – 3rd ed. – Springer –Verlag London Limited, 2006. – 340 p.
- Campbell-Walsh Urology / Wein А. et al. – 11th ed. – Elsevier Saunders, 2016. – 4902 p.
- Chapple Ch.R., MacDiarmid S.A., Patel A. Urodynamics made easy. – 3rd ed. – Elsevier Churchill Livingstone, 2009. – 222 p.
- Clinical Singapore Urological Assosiation Guidelines for male lower urinary tract symptoms / Benign prostatic hyperplasia // Singapore Med. J. – 2017. – Vol. 58. – P. 473-480.
- Consultation in neurourology / Corcos J., Przydacz M. – Springer, 2018. – 310 p.
- EAU Guidelines on management of non-neurogenic male lower urinary tract symptoms (LUTS) / Cornu J.N. et al. – EAU, 2024. – 124 p.
- EAU Guidelines on neuro-urology / Blok В., Panner J., Castro-Diaz D. et al. – EAU, 2024. – 44 p.
- Kadhim S. I. Effects of open prostatectomy on uroflowmetry parameters on patients having benign prostatic hyperplasia // International Journal of Sergery Science. – 2021. – Vol. 5. – P. 314-317.
- Kasivisvanathan V., Challacombe B. The big prostate. – Springer, 2018. – 196 p.
- Imtiyaz A., Iqbal A. Uroflowmetric study before and after suprapubic transvesical prostatectomy in patients of benign prostatic hypertension // International Journal of Scientific and research Publications. – 2019. – Vol. 9. – P. 449-454.
- ICS Standarts 2023. – 1256 p.
- Liao L., Madersbacher H. Neurourology. Theory and practice. – Springer, 2019. – 548 p.
- Lower urinary tract symptoms in adults. A clinical approach // Marcus Drake et al. – Springer, 2020. – 300 p.
- Male LUTS/BPH Made Easy // Chapple C.R., Tubaru A. – Springer, 2011. – 174 p.
- Male lower urinary tract symptoms / An International Consultation on Male LUTS. Fukuoka, Japan, September 30 – October 4, 2012 // Chapple C., Abrams P. – Monreal, 2013. – 548 p.
- Matulewicz R.S., Hairston L.C. UruCuff Test: a non-invasive alternative to ssure flow studies in adult males with lower urinary symptoms secondary to bladder outlet obstruction // The Canadian Journal of Urology. – 2015. – Vol. 22 (4). – P. 7494-7599.
- Neuro-Urology / Dmochowski R., Heesakkers J. – Springer, 2018. – 454 p.
- Textbook of the neurogenic bladder // Corcos J. et al. – CRC Press, 2016. – 3rd ed. – 800 p.
- Urological care for patients with progressive neurological conditions / Stoffel J.T., Dray E.V. – Springer, 2020. – 190 p.
Тематичний номер «Урологія. Нефрологія. Андрологія» № 1 (36), 2025 р.



 Горовий В.І.
Горовий В.І.

![Рис. 8. Дослідження «тиск/потік» при цистометрії спорожнення в пацієнта із ДГПЗ та обструктивним сечовипусканням: потік сечі низький (Qmax~4 мл/с) за високого Рdet (~100 см вод. ст.) [28]. Червоним колом позначено Рdet при Qmax Рис. 8. Дослідження «тиск/потік» при цистометрії спорожнення в пацієнта із ДГПЗ та обструктивним сечовипусканням: потік сечі низький (Qmax~4 мл/с) за високого Рdet (~100 см вод. ст.) [28]. Червоним колом позначено Рdet при Qmax](/multimedia/userfiles/images/2025/Uro_1_2025/Uro_1_2025_st22_pic8.webp)
![Рис. 16. Схематичне зображення багатоканального відеоуродинамічного дослідження в чоловіка із НДНСШ: відмічається баштоподібний сечовий міхур та двобічні міхурово-сечовідні рефлюкси. Vinf — об’єм стерильної рідини, уведеної в сечовий міхур [26] Рис. 16. Схематичне зображення багатоканального відеоуродинамічного дослідження в чоловіка із НДНСШ: відмічається баштоподібний сечовий міхур та двобічні міхурово-сечовідні рефлюкси. Vinf — об’єм стерильної рідини, уведеної в сечовий міхур [26]](/multimedia/userfiles/images/2025/Uro_1_2025/Uro_1_2025_st22_pic16.webp)
![Рис. 18. Номограма індексу обструкції шийки сечового міхура (ВООІ) (а) та індексу контрактильності детрузора (ВСІ) (б) [3, 13] Рис. 18. Номограма індексу обструкції шийки сечового міхура (ВООІ) (а) та індексу контрактильності детрузора (ВСІ) (б) [3, 13]](/multimedia/userfiles/images/2025/Uro_1_2025/Uro_1_2025_st22_pic18.webp)



![Рис. 24. Стадії ДГПЗ [13, 17] Рис. 24. Стадії ДГПЗ [13, 17]](/multimedia/userfiles/images/2025/Uro_1_2025/Uro_1_2025_st22_pic24.webp)
