18 квітня, 2025
Нові уявлення щодо стійкості нітрофурантоїну до розвитку резистентності уропатогенів
Упродовж 70‑річного використання в клінічній практиці нітрофурантоїн продемонстрував виняткову стійкість до розвитку резистентності уропатогенів. Його довгострокова ефективність зумовлена такими факторами, як швидке досягнення терапевтичних концентрацій, численні фізіологічні мішені проти бактерій, низький ризик горизонтального перенесення генів і необхідність накопичення множинних мутацій у патогенів для формування механізмів стійкості. Зазначені властивості обмежують виникнення й поширення резистентності до нітрофурантоїну.
Ключові слова: антибіотики, нітрофурантоїн, стійкість, резистентність, уропатогени, інфекції сечовивідних шляхів.
Інтенсифікація поширення резистентності до антимікробних препаратів становить серйозну проблему для глобальної системи громадського здоров’я. До більшості антибіотиків резистентність зазвичай виникає протягом десятиліття після першого їх клінічного застосування [1]. Однак нітрофурантоїн є винятком у цій тенденції, оскільки рівень резистентності до нього залишається низьким, попри високу частоту використання для лікування інфекцій сечовивідних шляхів (ІСШ) [2].
Нітрофурантоїн – синтетичний антибіотик, запатентований 1952 року компанією Eaton Laboratories (м. Норвіч, Нью-Йорк, США), після чого наступного року вперше надійшов у клінічне використання. Хоча на той час механізм його дії не був повністю вивчений, було відомо, що з-поміж інших ефектів він впливає на метаболізм бактерій через інгібування їхніх ферментів і перешкоджання синтезу клітинної стінки. Широкий спектр дії нітрофурантоїну проти грамнегативних і грампозитивних бактерій, включаючи такі поширені уропатогени, як Escherichia coli, Klebsiella spp., Enterococcus spp. та Staphylococcus spp., забезпечив його виняткову ефективність, і препарат почали широко використовувати для лікування неускладнених ІСШ [4].
На сьогодні нітрофурантоїн є одним з антибактеріальних препаратів, які найчастіше призначають для лікування ІСШ. Його включено до переліку основних лікарських засобів Всесвітньої організації охорони здоров’я (ВООЗ) [6]. Крім того, його емпіричне використання заохочується з огляду на включення до групи «Доступні» (Access) у класифікаційній базі даних AWaRe ВООЗ [7].
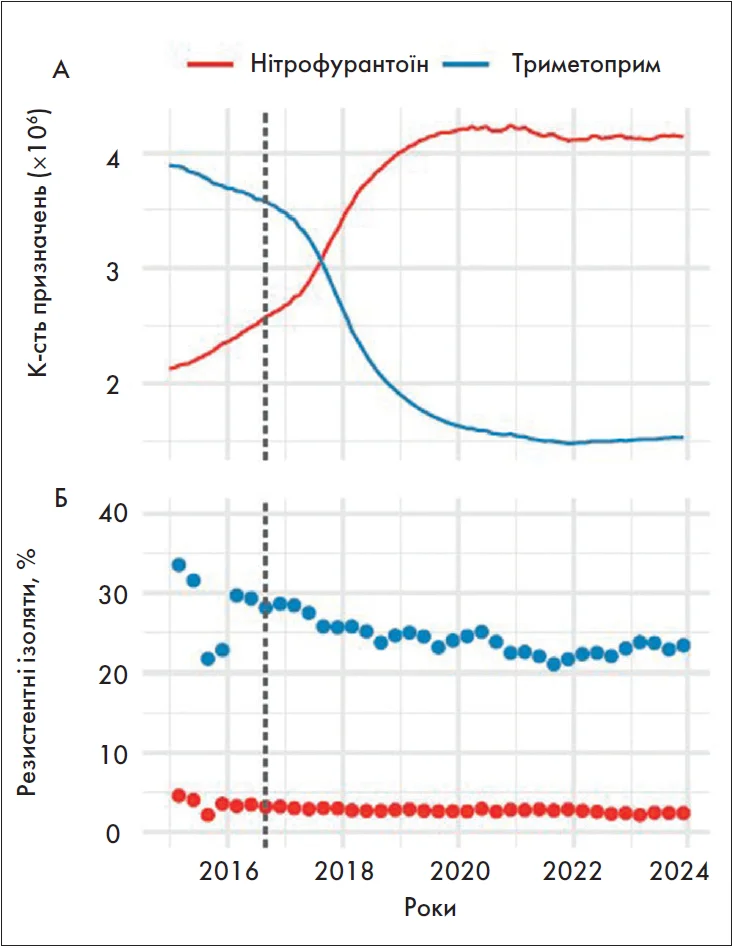
У 2016 році експерти Національної служби охорони здоров’я Великої Британії рекомендували замінити триметоприм на нітрофурантоїн як антибіотик першого вибору для лікування інфекцій нижніх сечовивідних шляхів [8]. Дані про призначення антибіотиків в Англії свідчать про постійне зростання кількості призначень нітрофурантоїну – із 35,3% у 2016 році до 73,1% у 2023 році разом зі скороченням використання триметоприму (рис.) [9]. У реальному вираженні середня кількість призначень нітрофурантоїну фактично подвоїлася в період між 2015 і 2020 роками (2,1 проти 4,2 млн рецептів/рік), залишаючись натепер відносно незмінною. Важливо, що протягом цього періоду резистентність до нітрофурантоїну не збільшувалася, залишаючись на рівні 2,5% для ізолятів E. coli та інших коліформних бактерій; також спостерігалося повільне зниження частоти виявлення ізолятів E. coli з резистентністю до триметоприму (рис.).
Рис. Кількість призначень нітрофурантоїну та рівень резистентності до нього (ковзні середні значення за 12 міс, дані з Англії, 2015-2023):
А – кількість призначень нітрофурантоїну та триметоприму;
Б – резистентність виділених із сечі ізолятів E. coli та інших коліформних бактерій до нітрофурантоїну та триметоприму. Вертикальні пунктирні лінії вказують період часу, у який відбувся перехід на нітрофурантоїн як антибіотик першого вибору
Властивості нітрофурантоїну, що зумовлюють його стійкість до формування резистентності уропатогенів
Швидке досягнення високих терапевтичних концентрацій у місці локалізації інфекції
Сприятливі фармакокінетичні та фармакодинамічні (ФК/ФД) властивості нітрофурантоїну, ймовірно, сповільнюють еволюцію резистентності уропатогенів [18-22], оскільки експериментально продемонстровано, що остання розвивається швидше за низьких концентрацій антибіотика [23]. Високі терапевтичні концентрації нітрофурантоїну досягаються швидко та є специфічними для локалізації інфекції у сечовивідних шляхах. Після перорального прийому нітрофурантоїн швидко виводиться із сечею в незміненому вигляді, досягаючи рівня >200 мкг/мл [3] – значно вищого за той, що запобігає формуванню резистентності (мутацій) (64 мкг/ мл) [24]. Це дозволяє нітрофурантоїну ефективно знищувати бактерії у сечовивідних шляхах до появи мутантних ізолятів, резистентних de novo.
Низькі позацільові концентрації
Терапевтичні концентрації нітрофурантоїну швидко досягаються в місці інфікування (сечовий міхур), при цьому позацільові його концентрації є низькими. У той час як його концентрація досягає >200 мкг/мл у сечі [3], вміст в інших рідинах організму є набагато нижчим. Зокрема, звичайний його рівень у плазмі крові становить <1 мкг/мл, що є нижче необхідного для виникнення мутантних резистентних мікроорганізмів [24]. Нітрофурантоїн швидко всмоктується з тонкої кишки, і лише 2% дози препарату ідентифікується у фекаліях [20, 28].
Важливо зазначити, що нітрофурантоїн не викликає дисбактеріоз мікробіому кишечника [32, 33] – стан, який може призводити до посилення колонізації патогенними мікроорганізмами.
Багатофакторний механізм дії на фізіологію бактерій
Один з аспектів стійкості нітрофурантоїну до розвитку резистентності до нього уропатогенів, імовірно, пов’язаний із його багатофакторним механізмом дії. Нітрофурантоїн сам по собі не є безпосередньо бактерицидним засобом; він активізується при відновленні нітрогрупи бактеріальними нітроредуктазами після поглинання клітиною [34]. У результаті генеруються реактивні проміжні продукти, дія яких спрямована на численні життєво важливі метаболічні процеси, такі як синтез білка, цикл лимонної кислоти (цикл Кребса) та синтез ДНК/РНК [3, 35]. Ці багатофакторні ефекти всередині бактерій значно ускладнюють процес формування резистентності, оскільки одночасне подолання кожного з уражаючих факторів потребує значних змін шляхом мутацій багатьох механізмів [3].
Необхідність численних незалежних мутацій для розвитку клінічної резистентності
Оскільки механізм дії нітрофурантоїну передбачає участь декількох різних бактеріальних нітроредуктаз, у тому числі NfsA і NfsB [36], поява резистентності de novo потребує змін у кількох генах-мішенях. Окремі інактивуючі мутації в обох генах nfsA і nfsB, як правило, необхідні для розвитку клінічної резистентності. Важливо, що інактивація тільки одного з генів, nfsA чи nfsB, забезпечує лише незначне підвищення мінімальної інгібуючої концентрації [24]. У поєднанні зі сприятливими ФК/ ФД-властивостями нітрофурантоїну це знижує ймовірність появи резистентності через поступову інактивацію генів nfsA та nfsB.
Одна велика делеційна мутація, яка одночасно інактивує обидва гени nfsA і nfsB, також є малоймовірним шляхом до розвитку резистентності, оскільки, незважаючи на функціональну схожість, nfsA та nfsB розташовані далеко один від одного в геномі.
Резистентність – як наслідок мутацій, а не горизонтального перенесення генів
Для багатьох антибіотиків, резистентність до яких стала звичним явищем, горизонтальне перенесення генів є основним шляхом її розвитку. Також у цьому процесі часто беруть участь ферменти, що інактивують антибіотики, цільові обхідні гени або нові ефлюксні насоси [43]. Такі гени часто переносяться мобільними генетичними елементами, такими як плазміди чи інтегрони, або отримані шляхом природної трансформації, що полегшує розповсюдження між видами [44, 45]. На відміну від багатьох інших антибіотиків, які часто використовують в клінічній практиці, перші два механізми резистентності відіграють лише незначну роль у її формуванні щодо нітрофурантоїну.Зменшення ролі горизонтального перенесення генів у виникненні резистентності до нітрофурантоїну може бути закономірним наслідком його синтетичного походження. Будучи повністю синтетичною сполукою, нітрофурантоїн, імовірно, не має природного резервуару генів резистентності. При цьому відомо, що багато широко застосовуваних антибіотиків отримують зі сполук, вироблених мікробами, й останні, можливо, первинно еволюціонували для міжвидової конкуренції [57].
Отже, у деяких випадках резистентність до антибіотика вже присутня в популяціях бактерій до початку його використання в клінічній практиці [62]. Призначення повністю синтетичних антибіотиків може допомогти знизити резистентність до них [63]. Однак не всі синтетичні антибіотики є стійкими до розвитку резистентності: наприклад, фторхінолони та триметоприм демонструють значно вищі її рівні [6].
Фактори, які сприяють виникненню резистентності до нітрофурантоїну
На думку вчених, розуміння того, як і чому виникає резистентність до нітрофурантоїну, може допомогти забезпечити його подальшу ефективність. Так, недотримання режиму лікування може відігравати значну роль у цьому процесі. Оскільки субінгібуючі концентрації препарату сприяють виникненню резистентності [23, 41], незадовільний комплаєнс може дозволити мутантним ізолятам першого етапу проліферувати й набувати мутації другого етапу. Забезпечення сталої концентрації нітрофурантоїну при ретельному дотриманні режиму терапії є вирішальним для запобігання розвитку стійкості до нього.
Призначення антибіотиків із профілактичною метою є потенційним фактором ризику збільшення резистентності до них. Профілактичне використання може зумовлювати вплив на бактерії субтерапевтичних концентрацій антибіотиків, сприяючи селекції й поширенню їхніх резистентних штамів [68]. Існуючі дані свідчать про відносно низький ризик розвитку резистентності до нітрофурантоїну при його застосуванні з метою профілактики ІСШ [69]. Загалом, нітрофурантоїн має нижчий рівень резистентності, ніж альтернативні антибіотики [72-74]. Утім рекомендовано продовжувати спостереження, враховуючи появу нових механізмів стійкості [46, 48, 49, 54].
Зростання резистентності до нітрофурантоїну відзначено в ізолятів із множинною медикаментозною (MDR) та екстенсивною (XDR) резистентністю, особливо серед карбапенем-резистентних Enterobacteriaceae (CRE). На додачу до типових мутацій у генах nfsA і nfsB, цьому процесу, ймовірно, сприяють надмірна експресія ефлюксних насосів [37, 77] та зменшення поглинання ліків через руйнування поринів зовнішніх мембран [77].
Отже, незважаючи на широке використання нітрофурантоїн залишається стійким до резистентності уропатогенів антибіотиком, рекомендованим для лікування ІСШ. Ця стійкість зумовлена декількома ключовими факторами, зокрема сприятливими ФК/ФД-властивостями та багатоцільовим впливом на фізіологію бактерій. Подальше раціональне застосування нітрофурантоїну сприятиме збереженню цієї важливої опції антибіотикотерапії ІСШ в умовах зростаючої антимікробної резистентності. Однак потрібно більше даних щодо чинників, які можуть подовжити період розвитку резистентності до нітрофурантоїну. Розуміння механізмів, які сприяють стійкості нітрофурантоїну, може виявитися корисним у розробці інших стійких антибіотиків та варіантів лікування.
Реферативний огляд підготувала Марина Малєй
За матеріалами: Kettlewell R., Jones C., Felton T.W. et al. Insights into durability against resistance from the antibiotic nitrofurantoin. npj Antimicrob Resist 2, 41 (2024). https://doi.org/10.1038/s44259-024-00056-1.
Тематичний номер «Урологія. Нефрологія. Андрологія» № 1 (36), 2025 р.