19 квітня, 2025
Злоякісний нейролептичний синдром: клінічна картина, методи діагностики та лікування
Злоякісний нейролептичний синдром (ЗНС) – це рідкісний неврологічний розлад, який характеризується розвитком непередбачуваних ускладнень після застосування препаратів, що блокують дофамін, особливо антипсихотиків. ЗНС проявляється підвищенням температури тіла, м’язовою ригідністю та дисфункцією вегетативної нервової системи (ВНС). Лікування ЗНС базується на емпіричних підходах, які включають використання міорелаксантів і ретельний моніторинг стану пацієнта, зазвичай у відділенні інтенсивної терапії. Пропонуємо до вашої уваги огляд статті E.F.M. Wijdicks та A. H. Ropper «Neuroleptic Malignant Syndrome», опублікованої у виданні New England Journal of Medicine (2024; 391: 1130‑1138), в якій представлені методи діагностики, зокрема диференційної, та лікування ЗНС.
У середині 1950-х рр. ХХ ст. впровадження хлорпромазину, який належить до нового класу антипсихотичних препаратів, стало значним досягненням у психіатрії. Антипсихотики були відкриті випадково, під час пошуку допоміжних засобів для загальної анестезії та аналгезії (Shen, 1999).
Антипсихотики, які блокують або змінюють функціонування дофамінергічної системи, є основними засобами лікування психозів, зокрема шизофренії (Seeman, 2021). Лікарські засоби із дофамін-блокувальними властивостями також застосовуються за станів, пов’язаних із делірієм, тривожних розладів, синдрому Туретта та нейрогастроінтестинальної дисфункції (Sadlonova et al., 2022; Garakani et al., 2022).
На ранньому етапі розвитку цих ліків було виявлено, що галоперидол може викликати як гіпокінетичні, так і гіперкінетичні моторні розлади, а також летальний синдром, що проявляється м’язовою ригідністю і гіпертермією. Цей стан отримав назву ЗНС. Психіатр Жан Деле (Jean Delay), який вивчав галоперидол, повідомив, що препарат пов’язаний із ризиком виникнення можливих вегетативних порушень або дисфункції ВНС (Delay et al., 1960).
Антипсихотичні засоби першого покоління (типові), такі як галоперидол, флуфеназин і пімозид, найчастіше асоційовані з розвитком ЗНС. Нині ці препарати все ще використовуються, зважаючи на їх ефективність та нижчу вартість порівняно із сучасними антипсихотиками (Trollor et al., 2012).
Матеріали з австралійської бази даних стосовно побічних реакцій на лікарські засоби свідчать про те, що ЗНС може виникати на тлі застосування антипсихотиків як першого, так і другого покоління (атипових). Однак препарати другого покоління характеризуються нижчою частотою розвитку ЗНС. Зокрема, при використанні клозапіну ЗНС проявляється менш виразною ригідністю, ніж інших ліків (Trollor et al., 2012).
Інші препарати, що блокують дофамін, такі як метоклопрамід, дроперидол, прохлорперазин, а також дофамін-виснажувальні засоби, наприклад тетрабеназин, також асоційовані з розвитком ЗНС. Однак імовірність виникнення ЗНС при їх застосуванні є значно нижчою (Friedman et al., 1985).
Синдром паркінсонізму-гіперпірексії, який є рідкісним станом, що нагадує ЗНС, може розвиватися після швидкого припинення приймання дофамінергічних засобів, що використовуються для лікування хвороби Паркінсона (ХП) (Friedman et al., 1985). У рідкісних випадках ЗНС спостерігається після використання стимуляції субталамічного ядра у пацієнтів із ХП на тлі відміни леводопи. Крім того, глибока стимуляція мозку може маскувати м’язову ригідність, що ускладнює діагностування даного синдрому (Govindappa et al., 2015).
Оскільки антипсихотичні препарати широко використовуються як у стаціонарних, так і в амбулаторних умовах, із проблемою ЗНС можуть стикатися медпрацівники різних спеціальностей. Зокрема, це сімейні лікарі, лікарі невідкладної допомоги, анестезіологи, реаніматологи, фахівці швидкої медичної допомоги та персонал закладів для осіб похилого віку.
Епідеміологія
За даними різних досліджень, ЗНС розвивається у близько 0,02‑3% пацієнтів, які отримували препарати, що асоційовані з цим станом. Частота залежить від досліджуваної популяції, типу препарату, тривалості його застосування, а також методів реєстрації та класифікації несприятливих реакцій (Strawn et al., 2007).
Дані масштабних досліджень, проведених в Японії та Австралії, свідчать, що смертність від ЗНС є нижчою при застосуванні атипових антипсихотиків порівняно із традиційними засобами (Nakamura et al., 2012; Trollor et al., 2012). Проте ця різниця може пояснюватися поліпшенням медичної допомоги в період переходу від використання типових до атипових препаратів.
У дослідженнях, які включали невелику кількість пацієнтів, описані такі фактори ризику розвитку ЗНС, як (Keck et al., 1989):
- зневоднення;
- застосування декількох антипсихотиків;
- високі та поступово зростаючі дози ліків;
- епізод ЗНС в анамнезі;
- внутрішньом’язовий шлях введення препаратів.
Водночас частота синдрому є настільки низькою, що достовірні асоціації з переліченими чинниками ризику залишаються недостатньо доведеними. Примітно, що багато випадків ЗНС описані навіть при використанні одного перорального препарату в стандартній дозі.
У пацієнтів з енцефалітом, асоційованим з анти-N-метил-D-аспартатними рецепторами, при лікуванні препаратами, які блокують дофамін, може спостерігатися підвищена схильність до розвитку симптомів, подібних до ЗНС. У дослідженні за участю осіб із цим типом енцефаліту в 47% хворих були описані «антипсихотична резистентність» і кілька ймовірних випадків явного ЗНС (Lejuste et al., 2016). Диференційна діагностика побічних ефектів антипсихотиків від проявів цього автоімунного енцефаліту досі залишається серйозним клінічним викликом.
Поліморфізми генів, що кодують ферменти метаболізму препаратів, транспортери лікарських засобів і молекули-мішені, можуть впливати на терапевтичну відповідь та збільшувати ймовірність розвитку ЗНС. Проте ці генетичні фактори досліджувалися лише на невеликих вибірках, переважно у японській популяції.
Наприклад, варіанти гена, що кодує цитохром P450 2D6 (CYP2D6), які уповільнюють печінковий метаболізм цих препаратів, не асоційовані зі зростанням ризику ЗНС (Iwahashi et al., 1999). Так, у пацієнтів із ЗНС було виявлене переважання алеля A1 гена, що кодує дофаміновий рецептор D2 (DRD2). Однак дослідження генів DRD2, HTR1A і HTR2A, що кодують серотонінові рецептори 1A і 2A, а також гена, який кодує ріанодиновий рецептор 1 (RYR1), залучений до розвитку злоякісної гіпертермії, не показали значущої різниці в частоті виникнення ЗНС між пацієнтами із цими генетичними особливостями та контрольною групою (Mihara et al., 2003).
Описано декілька поліморфізмів генів CYP1A2, CYP2D6, CYP3A4, CYP3A5 та ABCB1 (останній кодує білок-переносник із сімейства АВС), які впливають на фармакокінетику та рівні у плазмі таких препаратів, як оланзапін, клозапін, арипіпразол, рисперидон і кветіапін. Проте жоден із цих поліморфізмів не був однозначно пов’язаний із ЗНС (Carrascal-Laso et al., 2021).
Відомо про клінічний випадок пацієнта із шизофренією, в якого після лікування рисперидоном розвинувся «атиповий» ЗНС без ригідності. Він був носієм обох варіантів алелів CYP2D6. Подальше лікування оланзапіном, який переважно не метаболізується CYP2D6, не супроводжувалося побічними ефектами (Ochi et al., 2011).
Клінічна картина ЗНС
Згідно із критеріями Діагностичного та статистичного посібника з психічних захворювань 5-го перегляду (DSM‑5), обов’язковими критеріями для встановлення діагнозу ЗНС є (APA, 2013):
- попереднє застосування препарату, що блокує дофамін;
- виразна м’язова ригідність;
- гарячка;
- принаймні два із таких симптомів, як діафорез (надмірна пітливість), дисфагія (порушення ковтання), тремор, нетримання сечі, порушення рівня свідомості, мутизм, тахікардія, підвищений або нестабільний артеріальний тиск (АТ), лейкоцитоз, збільшена активність креатинфосфокінази (КФК) у сироватці крові.
На практиці ідентифікація ЗНС є простішою, ніж це може здатися на основі зазначених критеріїв. Зазвичай анамнез, перелік застосовуваних ліків і клінічний контекст дозволяють швидко припустити зв’язок із препаратом, що асоційований із розвитком ЗНС. Однак ця кореляція не завжди є очевидною, особливо у випадках, коли пацієнт приймав медикаменти, які не використовуються для лікування психозу чи делірію.
ЗНС здебільшого проявляється дисфункцією ВНС, яка характеризується тахікардією, швидкими змінами рівня АТ (гіпер- або гіпотензією), підвищенням температури тіла до 40 °C і більше, делірієм, що у тяжких випадках переходить у кататонію, збільшенням м’язового тонусу тощо. Першими ознаками синдрому часто є зміни АТ та м’язовий гіпертонус, хоча деякі дослідники наголошують на розвитку ранніх поведінкових змін.
Такий екстрапірамідний симптом, як м’язова ригідність за типом «свинцевої трубки» проявляється рівномірним опором під час пасивного руху кінцівки. Цей симптом можна тактильно диференціювати від спастичності, дистонії та спазму. Інколи ригідність супроводжується феноменом «зубчастого колеса», як за ХП. Однак незрозуміло, чи це паркінсонічний ефект препарату, що спричинив синдром, чи характерна риса ригідності при ЗНС. М’язова ригідність є менш вираженою при застосуванні антипсихотиків другого покоління, ніж першого (Trollor et al., 2012).
Інтенсивна ригідність може призводити до рабдоміолізу, різкого підвищення активності КФК у сироватці крові та розвитку ниркової недостатності. Лейкоцитоз також являє собою поширений прояв ЗНС. У разі екстрапірамідних розладів, як-от ХП, навіть тяжка ригідність зрідка спричиняє настільки виразне ушкодження м’язів. Імовірним поясненням є те, що ригідність за цих захворювань менш інтенсивна, ніж при ЗНС, і зазвичай не асоційована із гіпертермією.
Період між початком застосування препарату і появою симптомів у середньому становить чотири дні, а медіанна тривалість захворювання – дев’ять днів. Однак симптоми можуть з’явитися як через один день після початку терапії, так і через понад 30 днів (Kuhlwilm et al., 2020). ЗНС загалом або його окремі компоненти тривають кілька днів і зазвичай сягають піку інтенсивності на 2-й чи 3-й день після початку захворювання.
У клінічній практиці лікарі стикаються із ЗНС рідше, ніж із паркінсонізмом, викликаним антипсихотиками. Вважається, що паркінсонічні симптоми, такі як ригідність або дистонія, розвиваються у 30% пацієнтів, які отримують антипсихотичні препарати (Hardie et al., 1988). Ці прояви можуть помилково інтерпретуватися як ранні ознаки ЗНС, що ускладнює ранню діагностику.
Патогенез
Біологічна основа ЗНС залишається невідомою. Проте блокада дофамінових D2-рецепторів, які належать до сімейства сполучених із G-білками рецепторів, є ймовірним механізмом, що лежить в основі розвитку даного стану. Ці рецептори зв’язують позаклітинний дофамін і чинять інгібувальний ефект. Вважається, що вони є основними терапевтичними мішенями дії антипсихотиків, які застосовуються для лікування шизофренії та інших нейропсихічних розладів (Hardie et al., 1988). Дофаміновий D4-рецептор також асоційований із дією цієї групи препаратів, хоча не зрозуміло, чи антипсихотики (крім атипових) значною мірою впливають на нього (Wong et al., 2003).
Дослідження на тваринних моделях показали, що кількатижневе лікування галоперидолом спричиняє інактивацію нейронального збудження, відому як блокада деполяризації (Grace et al., 2023). Повторна блокада деполяризації дофамінергічних шляхів, викликана антипсихотиками, корелює зі збільшенням їх клінічної ефективності, а блокада нігростріатальної системи – з екстрапірамідними побічними ефектами (Toda et al., 2007). Ці відомості мають значення для розуміння механізму розвитку ЗНС. Проте дане питання ще недостатньо вивчене й потребує подальшого розгляду.
Інша гіпотеза, яка базується на даних досліджень початку 1990-х рр. ХХ ст., передбачає, що вегетативні симптоми ЗНС спричинені гіперактивністю симпатоадреналової системи. Це призводить до підвищення концентрації іонів кальцію всередині м’язових клітин, результатом чого є збільшення м’язового тонусу. Згідно із даним припущенням, блокада дофамінових рецепторів у гіпоталамусі порушує процеси тепловіддачі, а у хвостатому ядрі, блідій кулі й вентральному стриатумі спричиняє розвиток м’язової ригідності. Поєднання надмірного вироблення тепла зі зниженою тепловіддачею призводить до розвитку гіпертермії, яка є основною ознакою синдрому (Toda et al., 2007). У межах цієї гіпотези зміни психічного стану пояснюються виснаженням дофаміну в шляхах між середнім мозком, корою і лімбічною системою.
Натепер бракує доказів наявності первинного дефекту скелетної мускулатури або прямого токсичного впливу дофамін-блокувальних препаратів на м’язи. Однак в експериментальній моделі на тваринах було показано, що підвищення температури навколишнього середовища після внутрішньом’язового введення галоперидолу спричиняло збільшення електроміографічної активності (яку інтерпретували як ригідність) і активності КФК у сироватці крові. Ці ефекти зменшувалися при застосуванні дантролену (Tanii et al., 1996).
Інші синдроми гострої гіпертермії та ригідності
Диференційна діагностика ЗНС та інших станів, що супроводжуються ригідністю і гіпертермією, може бути складним завданням. Однак загальні умови, за яких розвиваються симптоми, анамнез та детальний аналіз тригерів і препаратів, що приймав пацієнт, є ключовими для встановлення правильного діагнозу.
Злоякісна гіпертермія
Злоякісна гіпертермія може виникати при використанні анестетиків та має спільні риси із ЗНС (підвищення температури тіла та м’язова ригідність). Відмінність полягає у клінічних умовах та часі появи симптомів після застосування препарату. Проте якщо антипсихотики використовувалися для індукції анестезії або були нещодавно призначені для лікування психічного чи іншого розладу, диференціальна діагностика може бути ускладненою.
Тепловий удар та інтоксикації
Тепловий удар, синдроми відміни та гостра інтоксикація рекреаційними наркотиками, такими як амфетаміни, кокаїн, MDMA (3,4-метилендіоксиметамфетамін) і фенциклідин, можуть супроводжуватися симптомами, подібними до проявів ЗНС.
Синдром відміни міорелаксантів
Різке припинення приймання міорелаксантів, таких як баклофен, може спричинити м’язову ригідність і зміни психічного стану, що схожі на прояви ЗНС.
Гострий серотоніновий синдром
У разі гострого серотонінового синдрому розвивається гостра дизавтономія, яку можна помилково прийняти за ЗНС. Однак є низка відмінностей: для серотонінового синдрому характерні гіперрефлексія, клонус, міоклонус і тремтіння, що не є ознаками ЗНС. При ЗНС спостерігається м’язова ригідність за типом «свинцевої трубки», тоді як при серотоніновому синдромі переважає спастичність. Серотоніновий синдром супроводжується гіперрефлексією, тоді як при ЗНС сухожильні рефлекси знижені або залишаються нормальними. Серотоніновий синдром може викликати міоклонус у ногах, який поширюється на грудну клітку, живіт, руки і навіть впливає на рухливість очей (Boyer et al., 2005). Обидва синдроми іноді супроводжуються салівацією.
Примітно, що метоклопрамід, який є потенційним тригером ЗНС, також може загострювати серотоніновий синдром. Є повідомлення про одночасний розвиток цих двох синдромів на тлі використання препаратів із подвійною (антидофамінергічною та серотонінергічною) дією, наприклад, тефлудазину.
Кататонія
Екстремальна кататонія, відома як летальна кататонія, також може нагадувати ЗНС, особливо в умовах відділення невідкладної допомоги за відсутності детального медичного анамнезу. Обидва стани інколи супроводжуються підвищенням рівня КФК у сироватці крові (Heckers et al., 2023). Діагностична плутанина виникає, коли ЗНС викликає стан, подібний до кататонії. Проте такі риси, як стереотипія, катаплексія та манірність допомагають відрізнити кататонію від ЗНС.
Лихоманка невідомого походження
ЗНС іноді розглядається як можливий фактор розвитку лихоманки невідомого походження, оскільки для обох станів характерний лейкоцитоз (Haidar et al., 2022). Водночас ЗНС може бути помилково діагностований як інфекційне ураження. Однак відмінність між цими станами зазвичай очевидна, оскільки прояви гарячки та інфекції (кожної окремо), не схожі на повну клінічну картину ЗНС.
Лікування
Лікування пацієнтів із ЗНС потребує інтенсивного клінічного моніторингу та контролю факторів ризику ускладнень і смерті. Окрім припинення приймання провокувального препарату (за можливості), терапія передбачає багаторівневий підхід до основних проявів синдрому, як-от нестабільність АТ, гіпертермія та рабдоміоліз через виразну ригідність і ризик дихальної недостатності (ДН) (Bienvenu et al., 2012).
Пацієнти із ЗНС можуть мати гостру ДН через ригідність м’язів верхніх дихальних шляхів, дихальної мускулатури та діафрагми. Також можлива аспірація слини або вмісту шлунка через неефективний кашльовий рефлекс. У таких випадках показані інтубація та проведення штучної вентиляції легень (ШВЛ). Виразна салівація може потребувати застосування муколітичних або антихолінергічних препаратів, таких як глікопіролат (McGeachan et al., 2017). Тяжкий перебіг ЗНС включає виразну ригідність, кататонію або сплутаність свідомості, температуру ≥40 °C і частоту серцевих скорочень ≥120 уд./хв.
Натепер немає клінічних настанов та уніфікованих стандартних рекомендацій щодо ведення осіб із ЗНС. Незважаючи на обмеженість даних проспективних досліджень, ефективними можуть бути різні терапевтичні підходи, а лікування має бути адаптованим до потреб конкретного пацієнта.
Серцево-судинні ускладнення
Більшість хворих на ЗНС мають тахікардію та коливання АТ. У молодих осіб ці симптоми можуть вважатися прийнятним побічним ефектом, однак у літніх пацієнтів з ішемічною хворобою серця вони здатні призводити до ішемії, викликаної надмірним навантаженням (інфаркт міокарда типу 2), і підвищення рівня тропоніну в сироватці крові. Чи можуть антипсихотики безпосередньо пошкоджувати серцевий м’яз, залишається невідомим (Wang et al., 2020).
Нейропсихічні симптоми
Для пацієнтів можуть бути характерними ступор і німота або, навпаки, збудженння та стан делірію. Для контролю цих симптомів (за уникнення повторного введення антипсихотиків) може бути використаний дексмедетомідин – селективний агоніст α2-адренорецепторів короткої дії з седативними та анксіолітичними властивостями.
Електролітні порушення та метаболічний ацидоз
Тяжкі випадки ЗНС супроводжуються гіпокальціємією, гіпомагніємією, гіпо- та гіпернатріємією, гіперкаліємією та метаболічним ацидозом. Ці порушення потребують відповідної корекції.
Рабдоміоліз і дегідратація
Переважна більшість пацієнтів із гарячкою страждають на зневоднення, а на тлі м’язової ригідності відбувається розпад м’язової тканини, що призводить до підвищення активності КФК (до 10 000 Од/л і більше). На початку захворювання активність КФК буває нормальною, що може створювати хибне відчуття відсутності тяжкого стану. Для підтримки еуволемії та лікування рабдоміолізу необхідне внутрішньовенне введення значних об’ємів рідин, із цільовим діурезом приблизно 200‑300 мл/год (Michelsen et al., 2019). У випадках тяжкої гіперкаліємії, гіпокальціємії, азотемії або перевантаження рідиною може розглядатися застосування діалізу.
Синдром здавлення
У виняткових випадках рабдоміоліз може спричинити компартмент-синдром (синдром здавлення, синдром підвищеного внутрішньофасціального тиску). Це потребує проведення фасціотомії.
Гіпертермія
Гіпертермія лікується антипіретиками, такими як пероральний парацетамол у дозі 1000 мг що шість годин. Також застосовується метод випарного охолодження із застосуванням аерозолів і вентиляторів або, що ефективніше, поверхневої терморегуляції.
Тяжкі гемодинамічні розлади
У тяжких випадках для контролю температури, тахікардії та нестабільного АТ можуть застосовуватися клонідин (агоніст α1-адренорецепторів) або блокатори кальцієвих каналів, такі як клевідипін або нікардипін (Colomy et al., 2023).
М’язова ригідність
Ригідність м’язів оцінюється під час клінічного огляду. У легких випадках для зниження м’язового тонусу можна застосовувати лоразепам, який сприяє розслабленню м’язів. Якщо м’язова ригідність зберігається або посилюється, рекомендоване використання дантролену – міорелаксанту прямої дії, який інгібує вивільнення кальцію в саркоплазматичному ретикулумі. Він зменшує ригідність, гіпертермію та активність КФК у сироватці крові (Ngo et al., 2019). Проте застосування високих доз дантролену асоційоване із ризиком гепатотоксичності, тому слід проводити ретельний моніторинг функції печінки.
Альтернативні методи лікування
Бромокриптин або амантадин можуть бути запропоновані як альтернативні препарати. Ці засоби є агоністами дофаміну, які витісняють із клінічної практики застосування антагоністів дофамінових рецепторів і зазвичай асоційовані з незначною кількістю побічних ефектів за короткострокового використання (Woo et al., 1986).
Показання до специфічної терапії
Специфічні дофамінергічні втручання зазвичай виправдані, коли основна температура тіла досягає 38‑40 °C, а ригідність є помірною або тяжкою. Про останнє свідчить перехід від легкої ригідності з феноменом «зубчастого колеса» (що визначається пальпаторно) до стійкої ригідності.
Електросудомна терапія
У загрозливих для життя випадках швидкий ефект може забезпечити електросудомна терапія. Вона використовується для пацієнтів, які не відповідають на інші методи лікування. Механізм впливу електросудомної терапії при ЗНС дотепер залишається невідомим, як і механізм її ефективності за депресії та кататонії (Morcos et al., 2019).
Оптимальна тривалість кожного виду лікування при ЗНС та методи регулювання чи припинення терапії ще не встановлені. Практичні підходи можуть варіювати залежно від відділення інтенсивної терапії. У деяких випадках фармакологічне лікування триває кілька днів, в інших – тижнів, особливо якщо провокувальний препарат має тривалий період дії.
Загальні принципи інтенсивної терапії включають профілактику стресових виразок у пацієнтів на ШВЛ та профілактику тромбозу глибоких вен із застосуванням підшкірного гепарину або еноксапарину (Cook et al., 2024; Samuel et al., 2023).
Після припинення приймання провокувального препарату його повторного призначення зазвичай уникають. Однак це може ускладнити контроль основного захворювання, для лікування якого він був призначений. Інші психотропні засоби, такі як літій, антихолінергічні та серотонінергічні ліки, за можливості також виключають, щоб уникнути плутанини в оцінюванні симптомів ЗНС. Негайне усунення ефектів антипсихотиків тривалої дії неможливе через їх пролонговане вивільнення. Деякі препарати потребують до 60 днів для виведення із кровообігу. У випадку пероральних антипсихотиків короткої дії спонтанне зниження концентрації препарату до низьких рівнів зазвичай відбувається протягом 3‑5 днів.
Основні методи в лікуванні пацієнтів із ЗНС
1. Дихальна підтримка:
- інтубація та ШВЛ при загрозі ДН через ригідність м’язів дихальних шляхів і діафрагми;
- уникнення аспірації шляхом ретельного моніторингу кашльового рефлексу та використання муколітиків або антихолінергічних засобів (наприклад, глікопіролату) при гіперсалівації.
2. Контроль гіпертермії:
- використання охолоджувальних пристроїв (випарне охолодження, поверхнева терморегуляція);
- застосування антипіретиків, наприклад ацетамінофену.
3. Корекція метаболічних порушень:
- усунення гіперкаліємії, гіпокальціємії, гіпонатріємії, метаболічного ацидозу;
- внутрішньовенне введення рідин для підтримання еуволемії та профілактики рабдоміолізу (цільовий діурез: 200‑300 мл/год).
4. Лікування м’язової ригідності:
- лоразепам для полегшення стану за легких випадків;
- дантролен як міорелаксант прямої дії за тяжких випадків;
- у разі стійкої ригідності та гіпертермії – бромокриптин або амантадин.
5. Профілактика ускладнень:
- профілактика тромбозу глибоких вен (гепарин або еноксапарин);
- профілактика стресових виразок у пацієнтів на ШВЛ.
6. Особливі втручання:
- електросудомна терапія для рефрактерних випадків;
- хірургічне втручання, наприклад фасціотомія у разі розвитку синдрому здавлення.
Покроковий підхід до лікування пацієнта із ЗНС у відділенні інтенсивної терапії продемонстровано на рисунку. Представлений алгоритм забезпечує систематичний підхід до лікування ЗНС, фокусуючись на стабілізації стану пацієнта та усуненні основних симптомів і ускладнень.
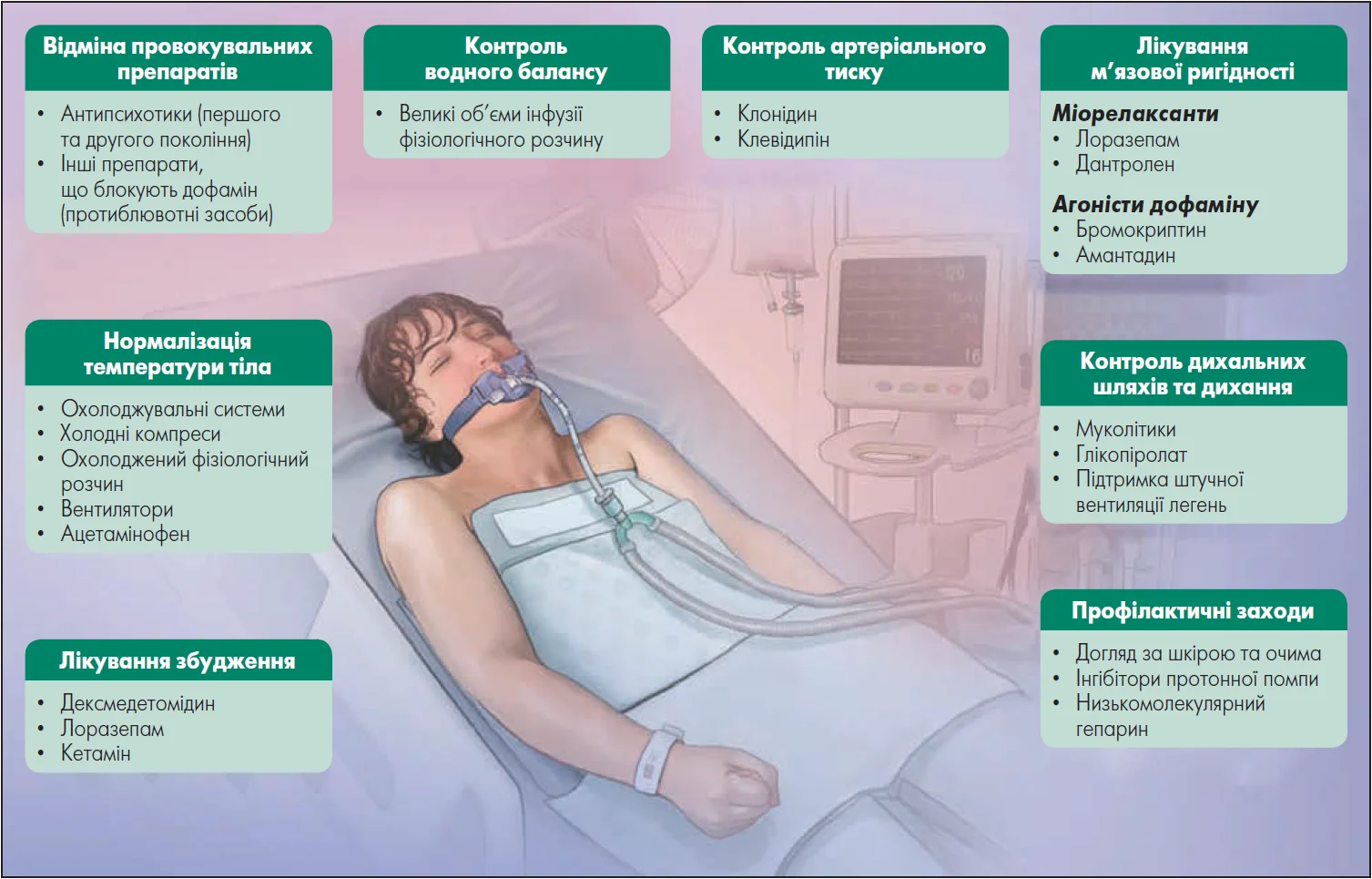 Рисунок. Ведення пацієнтів із ЗНС у відділенні інтенсивної терапії
Рисунок. Ведення пацієнтів із ЗНС у відділенні інтенсивної терапії
Адаптовано за E.F.M. Wijdicks та A. H. Ropper (2024)
Прогноз
Тривалість одужання при ЗНС зазвичай становить 7‑11 днів і може бути приблизно спрогнозована на основі тривалості періоду напіввиведення провокувального препарату (Woodbury et al., 1992). Крім того, різні терапевтичні підходи по-різному впливають на час до повного одужання. Наприклад, при використанні заходів підтримувальної терапії тривалість одужання в середньому становить 15 днів, при застосуванні дантролену – 9 днів, бромокриптину – 10 днів. Дані аналізу випадків свідчать, що застосування дофамінергічних препаратів асоційоване із нижчою смертністю порівняно із показником у пацієнтів, які не отримували ці засоби (Sakkas et al., 1991).
Описані лише одиничні випадки, за яких ЗНС тривав місяцями й супроводжувався резидуальними явищами кататонії та моторних розладів. Раніше рівень смертності від ЗНС у середньому становив 20‑30%; згідно із даними сучасних досліджень, цей показник знизився до 4,7% через 30 днів захворювання, до 9,9% через 90 днів та до 15,1% через рік. Це свідчить про можливі пізні ускладнення, такі як аспіраційна пневмонія або ниркова недостатність, що можуть бути летальними (Sakkas et al., 1991). Пролонгований період відновлення також підвищує ризик вентиляційно-асоційованої пневмонії та сепсису.
Як відомо, рекомендовано переводити пацієнта зі ШВЛ за умови:
- стабілізації функції легень;
- зменшення кількості бронхіальних виділень;
- зниження осьової ригідності, яка перешкоджає диханню.
Серед найчастіших ускладнень ЗНС виділяють рабдоміоліз і гостру ниркову недостатність, частота яких може сягати до 30% випадків у стаціонарних хворих із діагнозом ЗНС. Розвиток в осіб із ЗНС гострої ДН і сепсису, а також наявна супутня серцева недостатність не є незалежними предикторами смерті, хоча вони залишаються модифікованими факторами ризику розвитку ускладнень та несприятливого прогнозу (Modi et al., 2016).
Повторне призначення антипсихотиків пацієнтам які перенесли ЗНС, теоретично може спричинити рецидиви ЗНС навіть через два роки після першого епізоду (Wells et al., 1988). Проте через наявність основного психічного захворювання інколи потрібне відновлення терапії. Окремі групи експертів вважають, що варто очікувати приблизно два тижні або довше, якщо зберігаються будь-які прояви ЗНС, перед повторним призначенням антипсихотиків. Інші дослідники пропонують починати терапію із призначення засобів низької потужності (Rosebush et al., 1989).
Профілактика рецидиву ЗНС передбачає застосування низьких початкових доз антипсихотиків із повільним їх підвищенням. Корисним також буде перехід на атипові антипсихотики, такі як клозапін. Це може не запобігти рецидиву, проте ризик тяжкого перебігу або летального результату при цьому значно нижчий. У проведеному клінічному дослідженні лише у 5 із 119 пацієнтів із шизофренією, які отримували повторну терапію антипсихотиками, спостерігався рецидив ЗНС. Однак певний ризик рецидиву ЗНС, безумовно, залишається (Guinart et al., 2021).
Згідно із даними систематичного огляду, присвяченого ризикам лікування клозапіном на тлі різних розладів, повторне призначення препарату після ЗНС було успішним у всіх досліджуваних пацієнтів. Однак це не запобігло рецидиву агранулоцитозу або міокардиту, викликаних клозапіном (Manu et al., 2018). Таким чином, доцільно вказувати перенесений ЗНС як серйозну побічну реакцію на препарат у медичній документації пацієнта, щоб запобігти випадковому повторному призначенню потенційно небезпечного засобу.
Висновки
ЗНС є специфічним і тривожним станом, який виникає у пацієнтів після застосування препаратів, що блокують дофамін, особливо антипсихотиків, але не лише їх. Проте варто зауважити, що натепер залишається незрозумілим, які клінічні ознаки мають найбільше значення для діагностування цього синдрому, а також чи є він недооціненим, або навпаки, надмірно діагностованим станом. Причини більшості проявів ЗНС залишаються невідомими. Низька ймовірність рецидиву після повторного призначення провокувального препарату ставить під сумнів просте пояснення механізмів цього стану.
Терапія ЗНС здебільшого спрямована на контроль основних проявів синдрому – гарячки, дисфункції ВНС та м’язової ригідності. Методи лікування залишаються підтримувальними та емпіричними. Схему лікування корисно доповнювати препаратами, що підсилюють дофамінергічну активність, або електросудомною терапією.
Питання поширеності геномних варіантів, асоційованих із ймовірністю розвитку ЗНС, ризику виникнення та рецидиву ЗНС, а також особливості терапії пацієнтів із ЗНС потребують подальших досліджень у різних популяціях. Необхідними є глибше розуміння цього стану та поліпшення результатів лікування.
Підготувала Ірина Климась
Тематичний номер «Неврологія. Психіатрія. Психотерапія» № 1 (72) 2025 р.



